您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-06-02 08:17
摘要 目的:通过对国内外药典的试药通则进行全面比较,探讨如何修订完善《中国药典》试药通则。方法:对中、日、英、美四国药典及欧洲药典从试药通则的通用要求,体例格式,具体品种的分类分级以及关键指标的限度和方法等方面分别进行对比和讨论。结果与结论:《中国药典》试药标准应与国家化学试剂标准相协调,通用技术要求应丰富,试药品种的关键质量要求及其检测方法需增加,以使试药通则切实起到对药品检测的指导作用。
关键词:试药;中国药典;日本药局方;英国药典;美国药典;欧洲药典
药品检验检测中,试药质量是影响检测结果与检验效率的重要因素。各国药典均有专门的试药通则用来指导药品检验检测过程中试药的使用与管理,保证药品检测结果的可靠,同时为试药外部供应商评价产品质量提供依据。随着化工行业对化学试剂分类的细化、试剂质量的提高,各国药典在通用要求、体例格式、具体试药品种的分类分级以及关键质量指标的限度和检查方法等方面的要求也各有异同。为了更好地完善《中华人民共和国药典》(简称《中国药典》)试药通则,本文就上述“通用要求、体例格式、具体试药品种的分类分级”等方面进行了比较分析,为试药通则8001的修订提供参考。
1 试药通用技术要求
各国药典的通则,均有一个关于对试药的定义、范围、试药级别等信息的通用技术要求,用以对试药使用和管理提供宏观的技术指导。
1.1 《中国药典》[1]
通用技术要求分别列于凡例和“8001试药”项下,在凡例中规定“实验用的试药,除另有规定外,均应根据通则试药项下的规定,选用不同等级并符合国家标准或国务院有关行政主管部门规定的试剂标准。”在“8001试药”项下规定试药范围,并对配制滴定液、试液、缓冲液和杂质限度检查用标准溶液所使用的试剂按基准试剂、优级纯、分析纯与化学纯四个等级进行推荐。
1.2 日本药局方[2](JP)
通用技术要求在“9.41试药,试液”项下,包含以下内容:①试药的范围;②解释试药品种项下方括号内容是符合日本工业标准(JIS)要求;③部分试剂有JIS Q 0030认证的证书,保证国际单位制的可追溯性;④试剂名称与JIS不一致时,列出其JIS名称;⑤各论有品种对应的,应符合各论项下的要求;⑥检查方法除另有规定外应按照通则规定的方法。
1.3 英国药典[3](BP)
BP附录I(Appendix I)中的试药(A. General Reagents)与欧洲药典[4](EP)的试药(4.1Reagents,standard solutions,buffer solutions)在通用要求方面协同一致,具体包含:①关于供应商的信息是为了便于使用者获取试剂,并非欧洲药典委员会(EDQM)推荐该供应商;②试药会用斜体的“R”标识;③对试药的描述会使用一些代码,如用于秘书处识别的7位数字代码或化学文摘社注册号(CAS号);④如为有毒试剂,应按良好质量控制实验室规范(GLP)进行处理;⑤关于实验用水的说明;⑥试药和试液应存放在密闭的容器中,标签应符合相关的国家法律和国际协议。
1.4 美国药典[5](USP)
USP关于试药的通用技术要求最为细致和全面。在“试药,指示剂和指示液”章有五个方面的通用要求:①范围,分为美国化学学会(ACS)级别、USP或食品化学法典级别、以及“适当的级别”;②运输和存储要求;③重金属离子标准溶液;④试药、指示剂、缓冲液、比色溶液、滴定液的定义;⑤色谱溶剂与载气。本章的“试药”一节中又包含6个说明,分别为空白与对照,试药体例图示,目视检查,续滤液,R2O3的解释,试药检查的通用试验方法。
1.5 小结
对比各国药典,发现国外药典对试药的通用要求较为详细,既包含试药各论相关信息的解释又对试药的安全性、来源与供应、存储与运输等管理提出要求,可以对药品检测时试药的选择提供有效的指导。USP与JP的试药均与国家化学试剂标准进行过对接协调,如USP与ACS,JP与JIS。
2 体例格式
各国药典收载的试剂在体例形式和分类上有差异(图1),《中国药典》与USP分类较为详细,试药、试液、指示液、缓冲液与滴定液等均有独立的章节,JP仅分为两类:试药试液、标准溶液(含容量分析、颜色检查及其他标准溶液),EP仅将容量分析用的试药单独列出,其他部分合在一起。
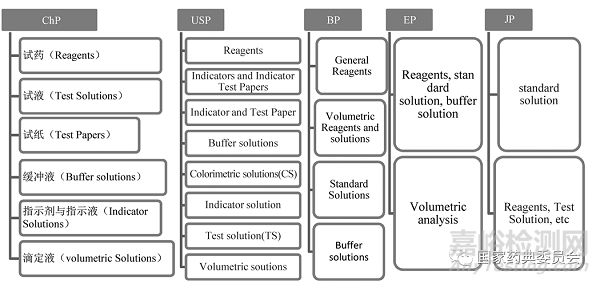
图1 各国药典的试剂分类
Fig.1 Classification of reagents in Pharmacopoeias
3 具体试药品种
各国药典收载的试药品种数量存在差异,BP1820余个,USP1250余个,JP1440余个,《中国药典》630余个。试药的分类分级和关键指标的质量要求方面,《中国药典》与国外药典也存在较大差距。
3.1 试药分类分级
试药分类分级应与使用相结合,《中国药典》在凡例中要求试药应使用不同等级,但具体试药品种项下目前没有类似色谱级、光谱级等分类分级方式的指导,药品检验检测的实验室在实际使用过程中为保证检测质量,通常直接采用已有分类分级的进口试剂。国外药典常见的试药分级有液相色谱级、气相色谱级、光谱级等,分类上还有供纯化用、供水分检查用、供色谱用、供核磁用、供紫外可见分光光度法用、供红外分光光度法用、无氧化物、无稳定剂等(表1)。对试药进行分类分级管理,可以指导使用者选择合适的试药,提高检测的准确性和效率。
表1 国外药典常见试药分类分级说明表
Tab.1 Classification of common reagents in foreign Pharmacopoeias

3.2 关键指标的质量要求
《中国药典》试药品种项下多数仅为物理化学性质的描述,国外药典会根据使用情况,对影响药品检测结果的试药增加关键指标的质量要求,如鉴别,水分,纯度等,有些还附有相应的检测方法,典型实例见表2。
4 对《中国药典》试药通则修订的建议
按照凡例的要求,药品检测用的试药需同时满足药典试药通则与国家试剂标准。但在实际工作过程中往往因为药典通则的试药标准尚未与国家化学试剂标准相协调、通则的试药标准过于简单难以用于试药质量的评价、试药等级和选择原则有局限[6]等因素,导致试药通则未起到指导作用,难以执行。试药质量直接影响药品检测结果[7-10],而试药通则应有效指导试药质量的评价,因此以国外药典和国家试剂标准为参考,结合药品检测过程中对不同试药的具体要求,对中国药典试药通则进行修订十分必要。
表2 典型试药的各国药典标准差异比较表
Tab.2 Comparison of the differences of typicalreagent in Pharmacopoeias

4.1 药典试药标准与国家化学试剂标准相协调
美国和日本等国家已经完成了药典试药标准与国家化学试剂标准相互协调的工作,当国家试剂标准可以满足药品检测需求时,直接在试药通则品种项下注明符合国家试剂标准,当药品检测有特殊要求时,在试药通则品种项下单独列出。《中国药典》也可以借鉴这种方式,既简化试药通则,又能提高试剂行业在药品检验检测中的参与度。
4.2 丰富通用技术要求
通用技术要求应至少包含试药的范围,级别,运输和存储,对有毒试药的处理,实验用水的说明,试药各论品种涉及的共性名词的定义或解释,以及试药各论品种涉及的共性检查方法等。
4.3 增加试药通则收载的品种
随着药典版本的不断更替,各论标准数量的逐渐增加,试药试液通则品种的收载落后于各论标准。通则应尽量做到对药典收载的药品标准正文所涉及试药的全覆盖,目前《中国药典》2020年版收载试药630余个,显著低于国外药典,且标准正文涉及到的试药和试液,有些是以附注等形式附在标准正文,如二部“硼砂”标准中使用的中性甘油,四部辅料“聚氧乙烯”标准中硝酸钙滴定液和“氢化大豆油”标准中乙醇制氢氧化钠滴定液,上述也应收载入相应通则中。
4.4 试药品种增加关键质量要求
目前《中国药典》试药品种项下多数仅为名称、分子式、分子量、性状以及部分理化常数等信息,难以通过这些信息来评价试药的质量。对药品检测结果影响较大的试药,应增加分类分级要求,并给出关键质量指标的限度,发挥药典通则评价试药质量和指导试药使用的作用。可以将试药按用途进行分类分级,如四氢呋喃,是由1,4-丁二醇脱水或呋喃氢化而得,在液相色谱分析中具有调节流动相极性,以达到改善峰的分离度和峰型的目的;四氢呋喃易被氧化,且紫外吸收很强,使用纯度低的试剂的会影响药品成分的分离检测。四氢呋喃中影响纯度的主要杂质有两类:一是其自身的氧化产物,多以γ-丁内酯为主,同时含有少量的2-羟基四氢呋喃、4-羟基丁醛、4-羟基丁酸、丁二酸等;二是为防止其被氧化而加入的各种抗氧剂。可以通过对四氢呋喃过氧化物和抗氧剂检测方法的研究,建立适合药品检测用途的试剂质量标准,将四氢呋喃根据用途进行分类分级,可分为无过氧化物、无稳定剂、液相色谱级、气相色谱级、光谱级和普通四氢呋喃,便于药品分析检测中使用。也可以将试药按含量进行分级,如二甲基亚砜,分为两级,主成分含量分别不得少于99.7%和99.9%。对关键质量指标,应规定限度,如光谱用乙腈,需检查光谱纯度,即规定在250~280nm波长项下的吸光度不得过0.01。
4.5 引入关键质量指标的测定方法
试药关键质量指标的测定方法,可以采用多种形式。对于与药品检测方法一致的检查项目,如水分、干燥失重、红外鉴别等,可使用药品检查对应的药典通则方法;对于其他具有共性的检查项目,如试药的氯化物、重金属、硝酸盐、硫酸盐检查等,可以参照USP,制定试药的一般检查法,列入通则的通用要求中;对于试药的个性化检查项目,如含量测定、特定杂质检查、理化鉴别等,可以在试药品种项下单独列出检测方法。在试药通则中引入关键质量指标的测定方法,既可以为试药进入实验室的验收提供方法,也可以对外部供应商评价提供技术依据,同时还能指导试药的存储,如根据灵敏度试验的结果制定合理的指示液有效期。
4.6 考虑增加试药品种的相应标识
USP与BP/EP标注了试药的CAS号,BP/EP还对部分试药标注一个7位数字代码,《中国药典》也可以借鉴这种标识方式,这可以既有效避免试药异名同物(如《中国药典》中的茜素红与茜素磺酸钠),也方便标准化管理中的识别,如试药的库存管理等。
国外药典的试药或试液出现在药品各论标准正文时会有相应的标识,如使用斜体,或用字母“R”或“TS”标识,提示其为专有名词,使用者可在通则中找到对应。《中国药典》正文有些试液并非专有名词,仅为“溶液”,如浓氨试液,其在通则无“浓氨试液”相对应。可以参考国外药典,建立适合《中国药典》的标识方式,让试药通则的使用更为高效和便利。
5 讨论
试药作为影响药品检测质量的一个重要因素,一直备受药品生产、检测单位的关注。由于现有试药均来自化学试剂,其质量标准一般采用全国化学标准化技术委员会(SAC/TC63)归口管理的GB体系,很多情况下不能满足药品检测的需求,导致药品检测单位选择进口试剂,建议《中国药典》试药通则的管理部门与国内的试剂生产企业的归口管理部门建立一种长效的沟通、协调机制,及时沟通、对接使用单位和生产单位的需求,既保证了试药的国产化供应,又提高了国内试剂行业的质量水平,促进检测行业和试剂行业的良性发展;同时为探索研究有生产企业加入的合作研究机制,提供解决当前问题的可持续的有效途径。
参考文献
[1] 中华人民共和国药典2020年版.四部[S]. 2020:391
ChP 2020.Vol IV[S].2020:391
[2] JP 17[S]. 2006:191
[3] BP 2020[S]. 2020:V-A23
[4] EP 10[S]. 2019:479
[5] USP 43-NF38[S]. 2020
[6] 吴越,王玉,张锐,等. 关于完善《中国药典》“试药通则”的建议. 中国药品标准,2020,21(4):339
WU Y, WANG Y, ZHANG R, et al. Suggestion on improving reagent chapter of the Chinese Pharmacopeia. Drug Stand China, 2020, 21(4):339
[7] 李艳.试药质量对药品检验结果的影响. 中国现代应用药学, 2015,32(11): 1414
LI Y.Impact of reagent quality on the drug inspection results. Chin J Mod ApplPharm, 2015, 32(11): 1414
[8] 马丽颖,张陈祎,郭亚新,等.检验检测机构化学试剂QC实验室的关键要素分析. 中国药事,2017,31(8):904
MA LY, ZHANG CY,GUO YX, et al. On the key points of chemical reagent QC laboratory in testing and inspection Institutions . Chin Pharm Aff, 2017, 31 (8): 904
[9] 侯爱荣,孙书美,尹爱群,等.试剂对药检工作的干扰. 药物分析杂志, 1998,18 (1):53
HOU AR,SUN SM, YIN AQ, et al. Interference of reagents on drug testing. Chin J Pharm Anal, 1998, 18 (1):53
[10] 黄雪芳. 试谈试剂质量对药品检验结果的影响. 当代医药论丛, 2014,12 (10):121
HUANG XF. Discussion on the influence of reagent quality on drug inspection results.Contemp Med Forum, 2014,12(10):121

来源:Internet


