您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-27 10:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
武田新一代降压药美阿沙坦钾片中国获批上市。武田新一代ARB类降压药物美阿沙坦钾片(易达比)获国家药监局批准上市,用于治疗成人原发性高血压。一项在中国开展的Ⅲ期临床结果显示,美阿沙坦钾40mg与缬沙坦160mg疗效相当,美阿沙坦钾80mg降压疗效显著优于缬沙坦160mg。同时,在中国人群中,美阿沙坦钾也显示出与其他ARB类药物相一致的安全性。
国内药讯
1.信谊万象别嘌醇片首家通过一致性评价。信谊万象药业别嘌醇片以补充申请形式获批通过一致性评价,为国内首家。别嘌醇片是治疗因尿酸过高引起的高尿酸血症、痛风的常用药物,为全国医保甲类品种。2019年中国公立医疗机构及中国城市实体药店终端别嘌醇销售额超过2亿元。值得一提的是,近年来别嘌醇在中国城市实体药店终端销售额均保持两位数增长。
2.阿斯利康哮喘新药中国获批新适应症。阿斯利康(中国)宣布,信必可®都保®(布地奈德福莫特罗吸入粉雾剂Ⅱ)已获得国家药监局正式批准,用于成人和12岁以上青少年轻度哮喘患者的抗炎缓解治疗。该新药是中国首个被批准用于治疗轻度哮喘的联合疗法,并将为轻度、中度和重度哮喘患者提供全程管理方案。此前,布地奈德福莫特罗吸入粉雾剂Ⅱ已经获批中重度哮喘的缓解加维持治疗。
3.康弘药业康柏西普眼用注射液申报新适应症。康弘药业「康柏西普眼用注射液」递交的第四个上市申请获CDE受理,申报的适应症为视网膜静脉阻塞(RVO)所致的黄斑水肿病变。康柏西普眼用注射液(商品名:朗沐)是一款重组融合蛋白。该药是我国首个获得世界卫生组织国际通用名的拥有全自主知识产权的生物1类新药,目前已获批3个适应症,即年龄相关性黄斑变性、糖尿病黄斑水肿和病理性近视脉络膜新生血管。
4.MorphoSys/天境生物C5aR1靶向单抗美国临床启动。天境生物与MorphoSys联合开发的C5aR1靶向单抗TJ210/MOR210美国Ⅰ期临床首例患者给药。该研究旨在评估TJ210/MOR210用于治疗复发或难治性晚期实体瘤的安全性、耐受性、药代动力学和药效学特征。临床前研究表明,TJ210/MOR210与免疫检查点抑制剂联用具有很好的抗肿瘤活性。此外,在体外研究中,高C5a浓度下也观察到其能长时间阻断C5a/C5aR活性。
5.海思科BTK-PROTAC抗肿瘤药物申报临床。海思科旗下四川海思科申报的HSK29116散剂的临床试验申请获CDE受理。HSK29116 是基于海思科PROTAC研发平台开发的一款口服蛋白水解靶向嵌合体(BTK-PROTAC)小分子抗肿瘤药物,可选择性阻断BTK激酶活性,通过调节信号通路干预B细胞发育,从而控制各种B细胞恶性肿瘤的进展。目前,国内外尚无同靶点同机制产品进入临床试验。
国际药讯
1.Moderna启动增强版新冠疫苗开发。Moderna公司新冠疫苗mRNA-1273在体外实验中显示出对新冠突变病毒株有效。接种mRNA-1273个体的血清对包括最初在英国和南非发现的B.1.1.7和B.1.351病毒株在内的多种关键性突变体产生中和效应。B.1.1.7突变体对中和滴度无显著影响;与先前突变体相比,B.1.351突变体的中和滴度降低了6倍,但仍高于预计能够提供保护的水平。研究成果已在预印本网站bioRxiv发布。目前,该公司已启动临床前和Ⅰ期临床研究,检验一款针对新冠突变病毒株的mRNA疫苗(mRNA-1273.351)作为增强疫苗的功效。
2.艾伯维JAK抑制剂欧盟获批新适应症。欧盟委员会(EC)批准艾伯维(AbbVie)JAK抑制剂Rinvoq(upadacitinib)扩展适应症,单药或与甲氨蝶呤联用,治疗对类风湿关节炎药物(DMARDs)疗效不佳的成人活动性银屑病关节炎(PsA)患者。Rinvoq同时还获批用于治疗常规疗法效果不佳的成人活动性强直性脊柱炎(AS)患者。这是这款JAK抑制剂首次获批治疗这两类患者群体。据悉,upadacitinib目前还在其它多个炎症性适应症中进行评估,包括克罗恩病、溃疡性结肠炎,以及特应性皮炎。
3.辉瑞/默克Bavencio一线维持治疗尿路上皮癌欧盟获批。欧盟委员会批准辉瑞/默克PD-L1疗法Bavencio(avelumab)用于一线维持治疗接受含铂化疗后病情没有进展的局部晚期或转移性尿路上皮癌(UC)成人患者。在一项关键Ⅲ期临床JAVELIN Bladder 100研究中,与最佳支持治疗(BSC)相比,Bavencio作为一线维持治疗和BSC联用显著改善了总生存期(OS),两组中位OS分别为21.4个月(95%CI:18.9-26.1)和14.3个月(95%CI:12.9-17.8);将总体人群的死亡风险降低31%。
4.BioCryst口服疗法Orladeyo日本获批上市。日本厚生劳动省(MHLW)批准BioCryst公司小分子疗法Orladeyo(berotralstat)上市,用于成人和12岁及以上儿童患者遗传性血管水肿(HAE)的预防。Orladeyo也是日本获批的唯一一款预防性HAE疗法,150 mg每日一次口服用药,可通过降低血浆激肽释放酶的活性来预防HAE发作。FDA已于2020年12月批准该疗法在美国上市。BioCryst的合作伙伴Torii公司将负责Orladeyo在日本的商业化。
5.Impel NeuroPharma偏头痛新药申报美国上市。FDA受理Impel NeuroPharma鼻腔给药的甲磺酸二氢麦角胺(DHE)INP104(Trudhesa)的新药申请(NDA),用于成人偏头痛(有或无先兆)患者的急性治疗。利用Imple的推进式POD技术,INP104能够将DHE的最佳剂量输送到血管丰富的上鼻腔。一项Ⅲ期研究STOP301结果显示,鼻腔给药后的2小时内,有66.3%的患者疼痛缓解、38%的患者报告头痛消失、52%的患者最烦人的偏头痛症状(MBS)消失,16.3%的患者可在15分钟内获得疼痛缓解。
6.罗氏长效双抗faricimab达Ⅲ期主要终点。罗氏VEGF-A/Ang-2双抗faricimab治疗新生血管性年龄相关性黄斑变性(nAMD)的两项国际Ⅲ期临床TENAYA和LUCERNE获积极的顶线结果。与VEGF抑制剂活性对照组(每8周一次注射)相比,faricimab治疗组患者的视力结果达到非劣效性标准。两项研究中有约45%的患者在第一年仅需要每16周接受一次faricimab治疗,这是首次治疗nAMD的眼部注射药物在Ⅲ期临床中可以达到这种持久性水平,nAMD患者通常每月都需要接受眼部注射。该公司表示尽快将相关数据提交给全球监管机构。
医药热点
1.浙江公布互联网医疗服务价格。浙江省针对该省各级公立医疗机构公布了第一批“互联网+”医疗服务项目收费标准。据了解,此次公布的第一批“互联网+”医疗服务包括互联网诊疗、远程会诊、远程监测3类,试行期2年。浙江规定,互联网复诊项目均按线下普通门诊诊查费项目价格收费;单学科远程会诊,副主任医师和主任医师的收费标准分别为180元/次和200元/次。
2.第四批国采2月3日照常进行现场报价。上海阳光医药采购网发布《关于开展全国药品集中采购文件解读的通知》,为申报企业提供线上学习资料。文件明确,第四批集采还将照原计划于 2 月 3 日进行现场报价。如因疫情防控原因调整地点,则另行通知。据了解,国采办此前曾因疫情防控工作取消了全国药品集中采购现场培训会。
3.印度首都超一半市民曾感染过新冠病毒。印度首都新德里于1月10日至23日开展第五轮针对新冠病毒的血清抗体检测。调查人员在首都280个地区共收集了2.8万个样本。初步结果显示目前有60%的被检人群的血清抗体为阳性。《今日印度》网站称,新德里约有2000万人,这意味着至少有1000万人已经感染过新冠病毒。
4.瑞士已发现近1000例变异新冠病毒感染病例。当地时间25日,据瑞士新闻通讯社Keystone-SDA报道,瑞士联邦公共卫生部统计数据显示,瑞士已发现近1000例变异新冠病毒感染病例。其中,超过470例感染了英国发现的新冠病毒变异株,16例感染了南非发现的新冠病毒变异株,尚未出现巴西发现的新冠病毒变异株感染病例,但有近490例病例感染的新冠病毒变异株与以上三种毒株都不匹配。
股市资讯
【天士力】全资子公司“江苏帝益”收到国家药品监督管理局颁发的关于盐酸二甲双胍片0.25g规格的《药品补充申请批准通知书》,该药品通过仿制药一致性评价。
【华润双鹤】中/长链脂肪乳注射液(C8~24)获得药品注册证书。
【博济医药】预计2020年归母净利润1600-2080万元,同比增长142.70%-215.50%;扣非归母净利润985.70-1465.70万元,同比增长436.47%-697.71%。
审评动向
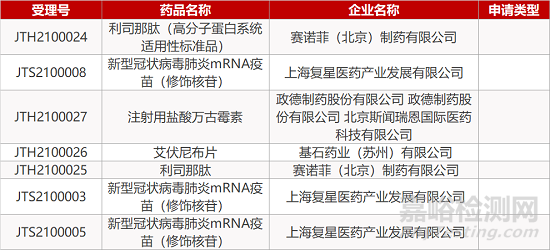
1. CDE最新受理情况(01月26日)
- The End -

来源:药研发


