您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-31 10:18
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:14条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.国药集团新冠灭活疫苗保护效力达79.34%。国药集团中国生物北京公司新冠灭活疫苗Ⅲ期临床结果积极。期中分析数据显示:新冠灭活疫苗接种后安全性良好,免疫程序两针接种后,疫苗组接种者均产生高滴度抗体,中和抗体阳转率为99.52%,疫苗针对由新冠病毒感染引起的疾病(COVID-19)的保护效力为79.34%。目前,该公司已正式向国家药监局提交附条件上市申请。
2.正大天晴阿法替尼获批上市。正大天晴4类仿制药马来酸阿法替尼片获国家药监局批准上市,成为继豪森药业和齐鲁制药之后该品种国内获批的第三款仿制药。阿法替尼属于第二代EGFR-TKI,由勃林格殷格翰原研,已于2017年2月获批进口中国,用于一线/二线治疗EGFR突变阳性的非小细胞肺癌。据查询,国内该品种按新4类提交上市申请的厂家还有石药集团、扬子江、科伦药业等5家。
3.石药欧意达沙替尼即将获批。石药欧意4类仿制药达沙替尼片上市申请处于“在审批”状态,有望近期获批,成为该品种首个通过一致性评价厂家。达沙替尼属于酪氨酸激酶抑制剂,由BMS原研,于2011年8月获批进口中国,用于治疗对甲磺酸伊马替尼耐药,或不耐受的费城染色体阳性(Ph+)慢性髓细胞白血病(CML)慢性期、加速期和急变期(急粒变和急淋变)成年患者。目前在国内仅有BMS原研和正大天晴的首仿上市。
4.赛诺菲度普利尤单抗新适应症获批临床。赛诺菲按2.2类提交的度普利尤单抗注射液新适应症临床申请获CDE默认许可,拟开发用于治疗慢性鼻窦炎不伴鼻息肉(CRSsNP)。度普利尤单抗是一款IL-4/IL-13双效抑制剂,于2017年3月首次在美国获批上市,用于治疗特应性皮炎。在中国,该新药已于今年6月获批用于治疗成人中重度特应性皮炎;目前通过谈判方式已成功被纳入2020年医保目录。
5.润佳医药完成B轮融资。润佳医药宣布完成4亿元人民币B轮融资,本轮融资由君实生物领投,募集资金将用于加速推进多个产品在全球范围的研发、IND申报和上市等。公开资料显示,润佳医药重点研发针对退行性疾病、肿瘤的1类小分子药物,目前拥有一条超过12种候选药物的产品管线。值得一提的是,该公司与君实生物曾达成合作,君实生物获得润佳医药旗下两款小分子抗肿瘤药物(泛CDK抑制剂和小分子α特异性PI3K抑制剂)的50%权益。
国际药讯
1.罗氏PD-L1日本获批一线治疗PD-L1高表达NSCLC。日本厚生劳动省批准罗氏旗下中外制药抗PD-L1疗法Tecentriq(泰圣奇,阿替利珠单抗)一线治疗化疗初治、PD-L1阳性、不可切除性晚期或复发性非小细胞肺癌(NSCLC)患者。在一项III期IMpower110研究中,与化疗相比,Tecentriq一线治疗显著延长这类患者的总生存期(中位OS:20.2个月vs13.1个月,HR=0.595,95%CI:0.398-0.890,p=0.0106)。至此,在日本治疗NSCLC方面,Tecentriq已获批5种不同的治疗方法。
2.诺和诺德欧盟提交司美格鲁肽标签扩展申请。诺和诺德宣布已向欧洲药品管理局(EMA)提交了一份标签扩展申请,在每周一次GLP-1类似物Ozempic(semaglutide,司美格鲁肽皮下制剂,每周一次)的现有营销授权中引入2.0mg的新剂量。目前,Ozempic在欧盟批准的是0.5mg和1.0mg剂量,用于治疗2型糖尿病成人患者。在一项临床SUSTAIN FORTE试验中,与1.0mg Ozempic相比,2.0mg Ozempic显著改善了需要强化治疗的2型糖尿病患者的血糖水平,而且安全性、耐受性良好。
3.Aprea公布p53靶向小分子疗法Ⅲ期主要终点结果。Aprea Therapeutics公司小分子靶向疗法eprenetapopt治疗TP53突变型骨髓增生异常综合征的Ⅲ期研究未达主要终点。与阿扎胞苷相比,eprenetapopt联合阿扎胞苷未能显著提高患者的完全缓解率(33.3%vs22.4%)。详细结果将于科学会议上公布。Eprenetapopt旨在重新激活突变型和失活的p53蛋白,从而诱导人类癌细胞凋亡。据悉,该疗法与传统抗癌药物(如化疗药物)、新型抗癌药物以及免疫检查点抑制剂存在协同作用。
4.囊性纤维化组合疗法Trikafta在加获优先审评资格。加拿大卫生部授予Vertex公司三联组合疗法Trikafta(elexacaftor/tezacaftor/ivacaftor和ivacaftor)优先审评资格,用于治疗12岁及以上囊性纤维化(CF)患者。预计明年上半年获得最终批复。囊性纤维化是一种罕见的常染色体隐性遗传病,可由不同类型的CFTR突变引起。本月22日,Trikafta和Vertex公司的另两款囊性纤维化疗法(Symdeko和Kalydeco)在美国获批扩大适用人群,纳入携带多种不同类型CFTR突变的患者。
5.罕见病新药arimoclomol美国上市申请将延期审评。FDA宣布将Orphazyme公司口服HSPs共诱导剂arimoclomol治疗C型尼曼匹克病(NPC)的新药申请审评期延长三个月,最终评审意见将不晚于2021年6月17日公布。Arimoclomol旨在通过刺激细胞自身的热休克反应,诱导产生热休克蛋白,进而清除有缺陷的错误折叠蛋白与蛋白聚合物。该疗法正在开发用于四种罕见病的治疗,包括肌萎缩侧索硬化症、包涵体肌炎、NPC和戈谢病。此次审评期的延长不会影响arimoclomol获得儿科罕见病优先审评券,该申请仍拥有FDA优先审评资格。
医药热点
1.非法采集人类遗传物质最高可判七年。《中华人民共和国刑法修正案(十一)》由第十三届全国人大常务委员会第二十四次会议于2020年12月26日通过,自2021年3月1日起施行。值得关注的是,刑法修正案(十一)不仅多处修改医药领域,包括对生产、销售假药的规定,还对我国人类遗传资源以及基因编辑/克隆的人类胚胎植入人体或者动物体内等相关条例做出了修改。其中明确,非法采集人类遗传资源情节特别严重最高可判七年。
2.207个药品退市。12月29日,国家药监局发布了一则注销诺氟沙星胶囊等207个药品注册证书的公告。注销的207个药品注册证书中,有依申请注销的197个,不予再注册的10个。从此次注销的剂型来看,被注销的207个药品中,以片剂最多,达137个;其次是胶囊剂和丸剂各30个。其中注销药品注册证书最多的药企为东芝堂药业(安徽),申请注销38个。
3.华西医院高质量论文位居中国医疗机构首位。2020年“中国科技论文统计结果发布会”于12月29日举行,会上评选出“中国百篇最具影响国际学术论文”。2019年中国发表高质量国际论文59867篇,占世界份额的31.4%,排在全球第2位。其中,2019年发表高质量国际论文数量最多的世界高校中,清华大学、浙江大学、上海交通大学和北京大学4所大学进入前十;2019年发表高质量国际论文最多的世界医疗机构中,中国只有四川大学华西医院进入前20名。
股市资讯
【上海医药】全资子公司上海医药生物治疗(美国)有限公司的SPH3127获美国FDA药品II期临床试验资格,适应症为轻度至中度溃疡性结肠炎。
【万泰生物】公司已为养生堂完成溶瘤病毒的I期临床试验用药物,还未开展II期临床试验用药物的生产工作。鉴于此,经公司与养生堂协商后达成《关于 <溶瘤病毒技术转让及服务协议> 的补充协议》。
【迪瑞医疗】公司的鳞状上皮细胞癌抗原测定试剂盒(化学发光免疫分析法)产品获得医疗器械注册证。
审评动向
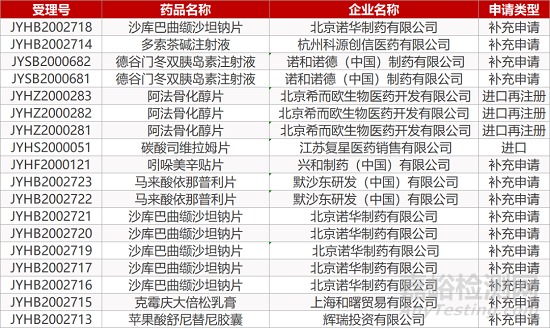
1. CDE最新受理情况(12月30日)
暂无
- The End -

来源:药研发


