您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-02-17 09:30
高效液相是目前在分析、检测中广泛使用的最基本检验仪器之一,尤其是药检行业中。根据现行的法规,即使是药典收载的高效液相方法,考虑到不同企业间生产工艺、检测水平的差异,也需要进行全面的方法验证。结合大量的文章和个人经验,本文对高效液相方法验证项目与进样方式进行了简单的讨论。
1、最新法规要求
高效液相检验的一般目的在于鉴别、有关物质检查、含量测定这3个主要目的,《中国药典》对于不同的使用用途下各验证项目有着详细的规定[1]。而生物基质(如全血、血清、血浆、尿)的色谱分析方法验证要求详见《通则9012生物样品定置分析方法验证指导原则》[2]。随着监管机构法律法规的不断更新,其对于方法验证的要求与ICH、FDA、EMA等不断接近,科学性和可操作性也有提升[3]。
根据最新的药典修订计划,《中国药典》2020年版拟将通则9101改名为“分析方法验证指导原则”,在验证项中着重突出专属性的要求(验证指标调整至第一项),删除校正因子,各项目的验证要求也根据新的监管要求发生了变化,检测项目和验证指标见表1[4]。
表1《中国药典》2020年版《分析方法验证指导原则》中验证项目[4]
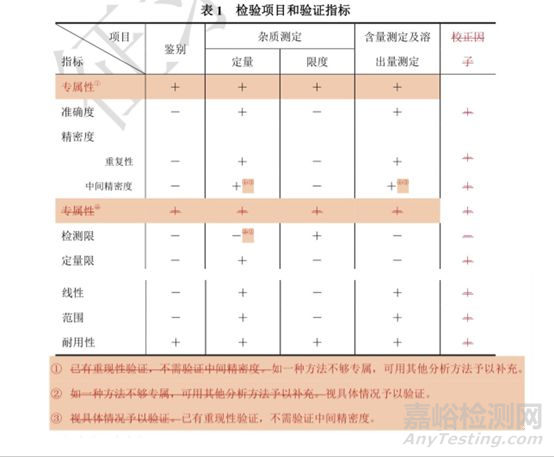
2、高效液相方法验证一般方案讨论
对于新的分析方法指导原则,仅需要着重指出的是专属性被调至方法验证的第一项,突出了专属性的重要性,因此在方法验证中需要考虑。本文接下来结合个人理解,选取药检领域最常用高效液相含量测定方法验证进行一般方案的讨论,见表2。
表2 高效液相含量测定方法验证一般方案讨论
|
# |
验证项目 |
进样方式 |
考察要点 |
|
1 |
专属性 |
流动相空白、基质空白、对照品、供试品、与供试品相似样品、供试品破坏样品,各进样1次。 |
分离度 峰纯度 |
|
2 |
准确度 |
供试品测量范围50、80、100、120、150%(或者扩大方法验证范围50、75、100、150、200%)的样品,以及分别与相同浓度对照品1:1混合,供试品和供试品加标样品各测定3次,计算回收率和回收率RSD。 |
回收率及其RSD
|
|
3 |
精密度-重复性 |
合并使用准确度项目中梯度浓度供试品的数据,计算含量RSD |
含量RSD |
|
4 |
精密度-中间精密度 |
按照准确度项目中梯度浓度供试品,由另一名实验员各测定3次,计算批间含量RSD |
含量RSD |
|
5 |
线性 |
合并使用准确度项目中梯度浓度供试品的数据,进行线性拟合 |
R2 截距 响应因子RSD |
|
6 |
范围 |
合并使用准确度项目中梯度浓度供试品的数据 |
根据线性、准确度、精密度结果和要求确定 |
|
7 |
耐用性 |
轻微改变流动相比例、pH值、柱温、流速、不同厂家批号色谱柱、不同仪器等,每个条件测试2次,与标准条件比较含量RSD(可合并使用准确度项目中100%浓度供试品的数据) |
根据风险评估结果确定 |
|
8 |
检测限、定量限 |
S/N=3和S/N=10,需结合理论计算结果制备低浓度验证样品验证S/N |
S/N 验证样品通常检测限应低于限度的1/30,定量限应低于限度的1/10[5] |
|
9 |
系统适用性 |
以对照品溶液重复进样5次,考察系统适用性指标 |
理论板数N 分离度R 拖尾因子T 重复性 灵敏度 |
注:
1、耐用性:耐用性的验证理论上可以无限做下去,甚至到方法重现、方法转移都与耐用性有着相通的原理,因此个人认为应该进行一个风险评估以确定需要着重考察的项目,或者在方法开发阶段予以解决。
2、检测限、定量限:对于含量检测不需要验证,但其原理与系统适用性中灵敏度具有相似性,可以作为该色谱系统条件评估的一个指标,个人认为可以制备低浓度的样品进行验证,而在有关物质检查中则要重点考虑检测限和定量限。
3、系统适用性:应加强对高效液相系统适用性试验的重视程度,如在《中国药典分析检测技术指南》中规定:以色谱中最难分离物质对或与其相关的物质对的分离度和待测物质的精密度作为系统适用性试验首选参数[7]。
4、方法验证中的合并设计大家在操作中多少都会用,如觉得不稳妥可以考虑样品测量次数由3次增加到6次,但合并设计涉及的法规风险和合规性尚需要细致的分析,这里是一个理念先拿出来。
5、高效液相含量分析方法验证的可接受标准可参照CDE电子刊物[8],研究时结合实际检测结果进行可接受标准调整。
3、案例分析
3.1鉴定(肽图)
表3 抗人TNF-α单克隆抗体液质联用肽图方法验证案例[9]
|
# |
验证项目 |
进样方式 |
考察要点 |
|
1 |
专属性 |
TNF-α单抗、利妥昔单抗(不同种单抗)、基质对照(成品辅料溶液) |
保留时间 |
|
2 |
系统适用性(文中称-重复性) |
同一TNF-α单抗样品消化溶液进样5次,计算CDR相对保留时间的RSD |
CDR相对保留时间RSD |
|
3 |
中间精密度 |
由2名不同人员在不同时间分别制备4份、2份TNF-α单抗消化溶液,计算CDR相对保留时间的RSD |
CDR相对保留时间RSD |
|
4 |
耐用性 |
对胰蛋白酶酶切条件(酶比例、酶切时间)进行了考察,计算CDR相对保留时间的RSD |
CDR相对保留时间RSD |
|
5 |
稳定性 |
分别考察了TNF-α单抗消化溶液在(8℃)的储存稳定性及-20℃的冻存稳定性,考察CDR相对保留时间的SD和RSD |
CDR相对保留时间SD和RSD |
注:
1、本方法验证时增加了相应的精密度指标,选取特征的CDR相对保留时间作为精密度指标,增加了鉴别实验中的重复性指标,并提高了实际验证的可行性,值得学习。
3.2杂质(纯度)
表4 贝伐单抗纯度(分子大小变异体)的方法学验证(USP-MP)案例[10]
|
# |
验证项目 |
进样方式 |
考察要点 |
|
1 |
专属性 |
基质对照(成品辅料溶液)、贝伐单抗标准品、贝伐单抗在55℃热处理2h的专属性样品 |
分离度 |
|
2 |
重复性 |
同1名实验员进行6次独立检验,计算峰面积RSD |
峰面积RSD |
|
3 |
中间精密度 |
2名实验员在2天各进行6次独立检验,计算批批间峰面积RSD |
峰面积RSD |
|
4 |
线性、范围和准确度 |
制备测量范围50、75、100、150、200%的样品,各进行6次独立检验,计算各个点的反算回收率和RSD,计算置信度。 |
反算回收率和RSD置信度。 |
注:
1、本方法验证参照了部分合并设计原则,而且已然是上市的药物的公开数据(USP-MP),具有一定的参考意义。
4、小结
对于高效液相而言,一般认为即使是法定方法,也需开展方法验证。方法验证项目按照新的方法验证指导原则进行选择即可,值得注意的是需要着重突出专属性。对于指导原则没有涉及到的项目,可结合风险评估原则适当增加方法验证项目。至于进样方式上可以进一步地参考合并设计的原则,在满足数据量的前提下,进一步提高方法验证设计的科学性和简便性。
参考文献:
[1]《中国药典》2015年版,通则9101药品质量标准分析方法验证指导原则.
[2]《中国药典》2015年版,通则9012生物样品定置分析方法验证指导原则.
[3]许明哲,黄宝斌, 杨青云,等. 分析方法验证、转移和确认概念解析[J].药物分析杂志, 2015, 16(1):168-175.
[4]国家药典委员会,《中国药典》2020年四部通则增修订内容(第二十二批),9101 分析方法验证指导原则(第二次征求意见稿).
[5]梅希,2020版药典9101<分析方法验证指导原则>要点浅析,药事纵横,2019年6月3日。
[6]alamo, 高效液相检验时重复样与进针次数讨论,药事纵横, 2019年11月20日.
[7]国家药典委员会.中国药典分析检测技术指南[S]. 北京:中国医药科技出版社. 2017年,187-188.
[8]黄晓龙.含量测定分析方法验证的可接受标准简介.CDE电子刊物,2006年01月20日.
[9]桂芳,杨兰兰, 潘勇兵,等. 抗人TNF-α单克隆抗体液质联用肽图分析方法的建立及验证[J].药物分析杂志,2017,37(1):58-70.
[10]BEVACIZUMAB Summary Validation Report. February 28, 2014. Published on USP Medicines Compendium (https://mc.usp.org).

来源:药事纵横


