您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-06 09:42
前言
原研药上市后一般会给予5年的市场独占期,孤儿药独占期为7年,儿科用药独占期为6个月,新剂型、新适应症独占期为3年;在市场独占期内,FDA不会批准仿制药企业上市相应的仿制产品,即使在该期限内专利过期,原研药企业仍然可以单独占领市场。除了原研药有市场独占期外,首仿药也具有市场独占期为180天。首仿药即第一个仿制药,最早可以在新药上市后满4年申报,因此,所有的仿制药企业如果做好了充分的准备,都会在这一天争相向FDA递交自己的ANDA资料,一旦资料被受理,其首仿资格便会获得确认。对于仿制药公司,从长远角度,要想维持企业的市场利益,也需持续向市场输送新的、质量高的仿制产品。
反向工程的作用
大多数仿制药是口服固体制剂(如片剂、胶囊机),它们通常是有多种成分组成的,包括活性成分API和辅料,活性成分即具有药理活性、能发挥药效的成分;而辅料,虽然没有临床药效作用,但从某种程度上讲,它可能会影响到药品的质量、安全性和有效性。如处方中的稳定剂,能提高产品的稳定性;缓释制剂中的缓释材料,对药物的溶出有较大的决定性作用,进而影响体内吸收。因此,如果仿制药能与RLD保存相同的辅料种类和用量、相同的晶型、相同的制剂工艺,无疑会大大提高仿制药的成功率,并且缩短仿制时间。从某种程度上讲,反向工程是一个科学的、经济的、高效的仿制药研发手段之一。
处方成分的反向研究
剖析处方成分
原研药的处方一般可在FDA、PMDA、EMA、eMC等官方网站中找到,也可在其产品附带说明书中查找到,也可在DailyMed(仅限FDA批准药物)、原研厂家网站(不一定有)等网站上找到。有些辅料不仅对制剂成品的质量会产生作用,甚至会影响到体内的吸收(如SLS),因此,与原研药保持一致的处方成分,对产品开发的成功率有很大帮助。
处方成分定量研究
目前FDA没有仿制药口服制剂的辅料与RLD在用量上保持一致(parenteral drug需要Q1/Q2相同),并且对于原研企业来说,处方组成用量越保密越好,尤其是一些关键性的辅料,如下图1的Fortamet®,厂家将一些关键用量信息抹掉:
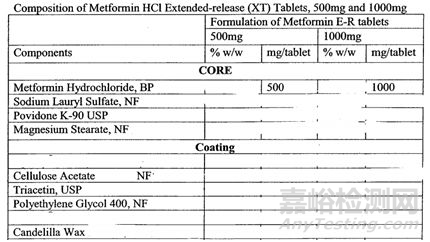
图1 原研企业公布的Fortamet®处方示例
但是,如果一些关键辅料如缓释材料、崩解剂、表面活性剂、润滑剂等的用量能被确定,无疑对后期处方开发与研究有很大的帮助,同时也会节省很多资金(试想中试一批的费用大多要花好几万,如果是API贵的、工艺复杂的,一批成本可能达到几十万)。
辅料的定量具有挑战性,主要的困难来自于产品中其它辅料或API的干扰,所以一般在对某种辅料进行定量前,会尝试采用一些手段将其提取出来,如通过组分间溶解度的差异进行分离,或通过过滤方式分离。下图2为用得较多的辅料定量检测手段:
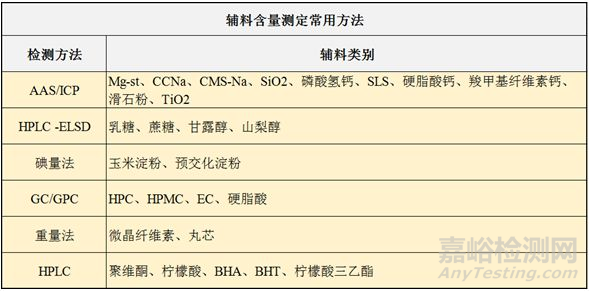
图2 辅料含量测定常用方法
对于在处方中重量占比大的建议用重量法/沉淀法,而占比小的(如稳定剂、表面活性剂、pH调节剂)等建议采用HPLC或HPTLC法。
活性成分研究
活性成分API的研究一般包括分子水平研究、粒径、密度等。
API分子水平研究
API的分子水平研究包括晶型、水合物、溶剂化物、无定形态,这些可能会影响到溶解度、生产可行性、生物利用度和稳定性等问题。在仿制药的研发过程中,API的多晶型是研究得最多的,也是最重要的。目前的法规并未要求仿制药需与RLD保持一致的晶型,但若存在多种晶型时,原研药一般会优先考虑最稳定性的晶型形态,以防止成品在生产过程中或在后期储存中发生转晶现象;而对于仿制药企业,也最好是选择与原研药保持一致的晶型形态,以保证能与RLD具有相似的稳定性和溶出释放相似性。但这里往往容易产生晶型专利问题。
目前监测晶型的方法有多种,如X射线粉末衍射(XRPD)、核磁共振(NMR)、Roman谱和近红外(NIR)谱、熔点测定法、电子显微镜法、差示扫描热量法(DSC)、密度法等。
API粒径研究
API的粒径是一个关键的研究点之一,尤其是对于难溶性药物。API的粒径分布(PSD)有时能直接影响到产品的溶出速率和生物利用度。难溶性药物一般可采用粉碎法或微粉化法考察筛选出一个适合的粒径范围。但因制剂成品中的辅料干扰,常规检测粒径的技术不适合制剂成品,目前可能可行的方法只有显微镜法。也可以查阅相关文献资料和专利获取信息。
API的密度
API的密度检测一般为退密度(BD,Bulk density)和振实密度(TD, Tapped density),根据这两组数据从而计算出Carr指数和Hausner指数,评估API的流动性,如下图3为QbDIR模板中的案例:

图3 QbDIR模板中对API密度的相关叙述
生产工艺
口服固体制剂一般采用湿法制粒、干法制粒、或者直接压片形式,根据API的稳定性、API在成品中的占比、流动性和可压性等进行选择,比如流动性差的不会选择直接压片形式,而对湿敏感的API一般也不会选择湿法制粒;同时,还需结合生产线上的设备进行最优的选择。
另外,在EMA中查询原料药和制剂成品的工艺步骤也是一种方式,如下图4为EMA中查询到的盐酸决奈达隆片的生产工艺步骤,依次为混合、湿法制粒、干燥、过筛、压片、包衣。

图4 EMA中查询到的盐酸决奈达隆片的生产工艺步骤示例
后记
总而言之,仿制药中的功能性辅料和API的理化性质(分子水平研究)是反向工程的重要步骤之一,甚至对仿制药的成功起着决定性的作用。解析处方成分用量会减少小试研究的次数,从而更快地找到最优处方,同时也有利于提高生物等效性的成功率;而原料药的形态学研究则有利于提高产品开发的可行度和后期产品的稳定性。对于仿制药企业而言,对RLD进行深入反向解析,无疑是一件既经济又省时的工作。
参考资料:
1. The Role of Reverse Engineering in the Development of Generic Formulations
2. EMA有你不知道的“秘密”
3. QbD速释制剂模板

来源:药渡


