您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-07-23 12:47
2025药典对《9101 分析方法验证指导原则》进行了重大修改,进一步推进了统计学在分析方法验证中的应用。如何运用统计学进行验证数据的报告成为分析工作者亟待解决的难题。
本文将对方法学验证中的两大关键性能指标“准确度和精密度”的数据报告要求进行解读,并详细的讲述如何运用传统的excel软件对验证数据进行统计,旨在帮助业界同仁尽快将法规要求落地实施。
一、准确度和精密度的单独评价
2025药典要求:所有的精密度试验都应报告标准偏差、相对标准偏差(变异系数)和适当的100(1-α)%置信区间或其他合理的统计区间。准确度试验结果应报告为在试样中已知添加量分析物的平均回收率,同时提供合理的100(1-α)%置信区间。
1.1 标准偏差和相对标准偏差
标准偏差和相对标准偏差均用于描述测试结果之间的离散程度,计算公式如下:

1.2 α如何取值
α表示显著性水平,用来衡量在假设检验中,实验结果可能出现错误的概率。α越小,则出错的概率越小。通常α取0.05,因为统计学上认为,如果一件事情的发生概率只有5%,那么就不太可能发生。
置信水平=100(1-α)%,当α取0.05时,置信水平为95%,即:有95%的信心认为真实的参数值位于计算出的置信区间内。
1.3 置信区间如何计算
置信区间由置信下限 (CL) 和置信上限 (CU)组成,表示总体参数在一定的置信水平下可能出现的范围为[CL,CU]。
在分析方法验证中,重复性的样本量通常为1×6,准确度的样本量通常为3×3或1×6,均属于小样本数据(n<20),宜采用t分布计算置信区间。公式如下:
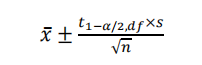
式中:df表示自由度n-1;
t1-α/2,df是自由度为df且置信水平为1-α时的t分布的1-α/2分位数。采用excel计算时,函数为TINV(α,df)。
√n采用excel计算时,函数为SQRT(n)。
1.4 数据报告示例
表1.4.1 重复性结果(示例)
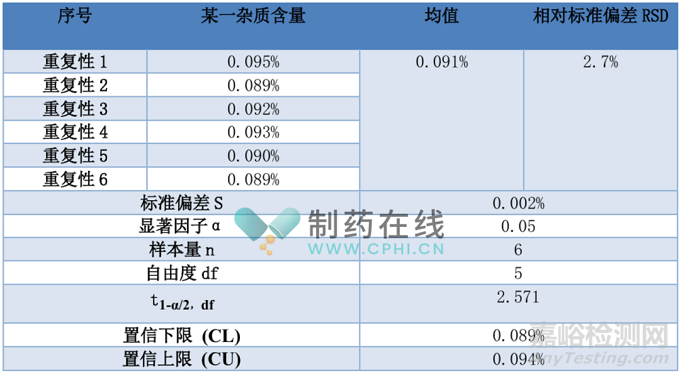
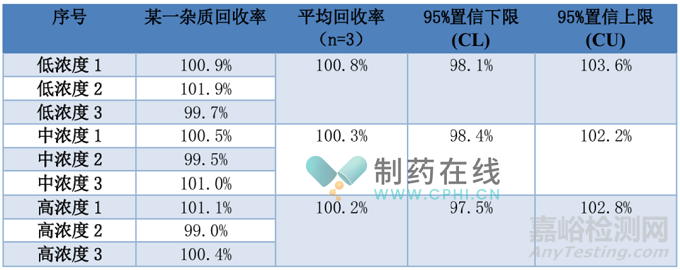
表1.4.2 准确度结果(示例)
二、准确度和精密度的联合评价
2025药典提出:准确度和精密度可以联合评价,统计方法可采用预测区间、容忍区间或置信区间,也可采用其他合理的统计学方法。
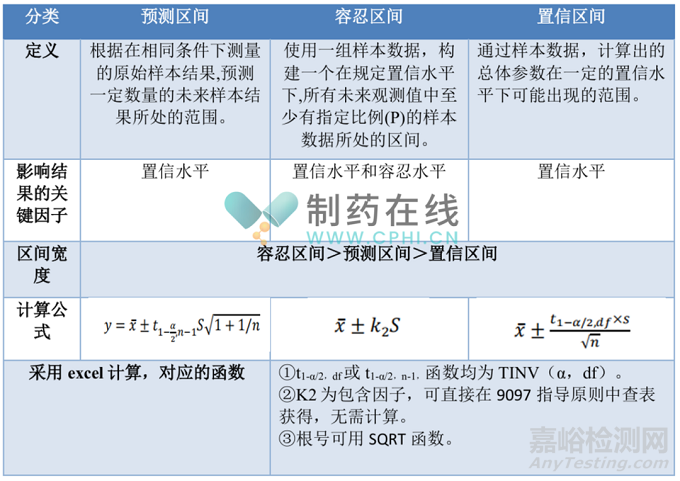
从上表可以看出,准确度和精密度的联合评价,本质都是通过对样品进行多次测定,计算出结果可能出现的范围,当此范围可接受时,即可认为方法准确。因此,准确度和精密度联合评价的前提是:已获得样品的真值或可接受的参比值。
联合评价的实验设计:①对于含量测定方法,原料药可用已知纯度的对照品或供试品进行多次测定;制剂可在处方量空白辅料中,加入已知量被测物对照品进行多次测定。②对于杂质测定方法,可向原料药或制剂中加入已知量杂质对照品进多次行测定。
细心的读者会发现,联合评价的实验设计思路与单独的准确度实验一致,只是结果判定的计算方式不同,且省略了精密度实验!!!因为精密不一定准确,但准确一定精密,联合评价通过充分的准确度实验同时表征方法的准确度和精密度。为了保证“联合评价”的可靠性,样本量至少≥10。
数据示例:对某一原料药的含量测定方法进行准确度和精密度的联合验证。取已知纯度为99.8%的对照品,按照供试品溶液的配制方法,平行配制10份。
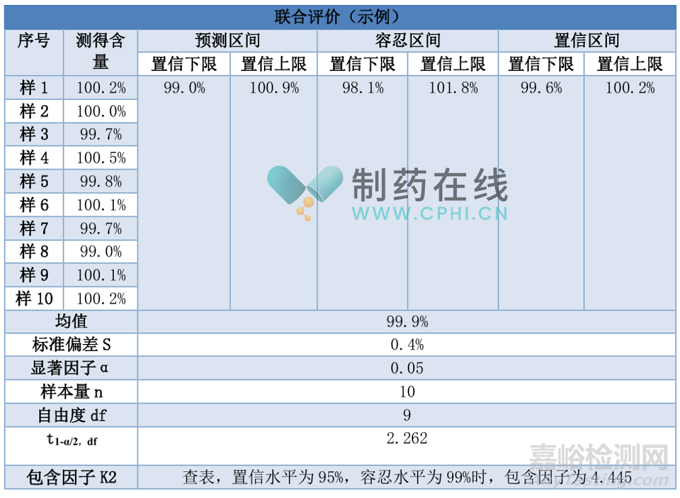
从上述统计结果可以看到,三种不同的统计方式所得到的区间范围大不相同。2025药典提出:一种统计学方法不一定适用于所有情况。如不适用,其他统计学方法可用于方法验证结果的评价。那么,实际运用过程中,到底以哪一种统计方式为准呢?
笔者认为:基于统计学的分析方法学验证,本质是通过验证表征方法的总体性能,并以此预测未来质量控制时的风险。这种方式更为科学,却对分析方法验证的实验样本提出更高的要求,因为统计结果的可靠性与样本量的大小密切相关,过小的样本量可能导致统计区间过宽,从而失去实际决策意义,但足够的样本量需要企业付出更高的实验成本。通常验证的样本量<20,综合考量统计方式对样本量的敏感性,建议优先选择“预测区间”,其次选择“置信区间”。
注:笔者水平有限,不足之处在所难免,请各位老师批评指正。
参考文献:
【1】《9101分析方法验证指导原则》
【2】《9097分析数据的解释与处理指导原则》

来源:智药公会


