您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-07-22 20:57
背景
近年来,全球生物制药发展迅速,市场规模庞大,在2018年全球药品销售额Top 10中,生物大分子药占据8个席位,包括单抗药物6个,融合蛋白2个,分别为阿达木单抗Humria(修美乐)、帕博利珠单抗Keytruda(可瑞达,“K药”)、曲妥珠单抗Herceptin(赫赛汀)、贝伐珠单抗Avastin(安维汀)、利妥昔单抗Rituxan(美罗华)、纳武利尤单抗Opdivo(欧狄沃,“O药”)和依那西普 (Etanercept)、阿柏西普 (Aflibercept)。
我国的生物制药也在紧跟脚步。企业如此,国家更是如此。NMPA意识到规范药品市场准入与药品上市许可管理的重要性,近年陆续出台了《生物制品注册分类及申报资料要求(试行)》、《治疗用生物制品注册申报资料指南(试行)》,2020版《中国药典》等,不断更新完善生物药品注册申报的程序和资料,为企业研发提供规范且先进的指导。政策开先河,企业也要跟上步伐。目前,国内企业在在表征方法建立及数据解读方面较弱,生物制药分析表征和质量控制方面还有待加强。具体而言,国内生物药企起步相对较晚,在生物制药表征分析方法建立方面借鉴国外方法更多,还较少进行新方法建立。特别是对于创新药的新特征,如何找到一种合适的表征方法,常常没有头绪。面对成分结构复杂的生物药,如何从数据中找出样品相关信息,判断数据相关性和合规性,避免出现与预期不符的情况,是国内生物药企需要提高的地方。
表征分类
人用药物注册技术要求国际协调会议ICH Q6B为生物技术产品的表征提供了一套统一的国际公认原则,以支持单抗药物的市场应用。该文件建议进行分析以提供有关生物或生物制药产品的以下信息:
生物药表征分析:
氨基酸序列
氨基酸组成
末端氨基酸序列
肽图
巯基和二硫键
糖基化结构
生物学活性等
工艺质量分析对于生物制药的生产至关重要,并且贯穿整个流程。在前期阶段,生物制药研发过程中需要分析测试,在工艺开发与放大过程中,更需要质量控制把关。因此结构确证研究是生物制品注册申报资料的必备要素,以生物类似药为例,需全面对比多批次稳定中试工艺生产的原液和原研药进行的结构分析,包括一级结构、高级结构、翻译后修饰和辅料等。
序列及结构-色谱质谱技术
使用反相高效液相色谱(RP-HPLC)和柱前衍生化技术进行氨基酸组成分析,或者采用柱后衍生化处理的离子交换色谱法来确定生物制药产品的氨基酸组成。
分子量
使用四极杆飞行时间质谱对完整和还原的mAb进行在线LC/ES-MS分析,彻底改变了以往完整分子量以及释放的轻链和重链的测量方法。
氨基酸序列和多肽测定
以抗体药为例,通过肽图分析,氨基酸测序,质谱分析等方法从DNA序列中推导氨基酸序列,并确认DNA衍生序列。另外,N-末端氨基酸序列(是否存在游离氨基酸或焦谷氨酸)和C-末端氨基酸序列(例如,存在或不存在C-末端赖氨酸)的变异性,重链等)应进行分析。
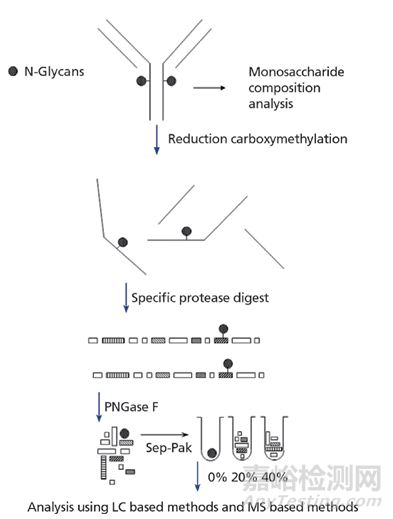
图1. LC/MS质谱技术
而蛋白序列分析,就是围绕以质谱技术为主的分析方法。肽图分析,使用特定蛋白消化酶,然后使用带有紫外UV和电喷雾质谱检测、可提供有关分子量的信息。为了分析mAb轻链和重链序列,将许多蛋白酶消化物与在线RP-HPLC和串联MS/MS(LC/ES-MS/MS)分析联合使用。N端测序,由于质谱的测序在大多数情况下无法区分异亮氨酸和亮氨酸(这些氨基酸具有相同的分子量),因此要明确分辨这两个氨基酸,就需要对纯化的肽在轻链和重链的可变区内进行自动N端测序。
末端氨基酸序列测定
进行末端氨基酸分析以鉴定mAb轻链和重链的氨基和羧基末端氨基酸序列。如果产品显示一个以上的末端氨基酸序列,则应确定末端的相对量。使用Edman化学法进行自动化的N末端测序,在蛋白质的N末端具有游离的氨基官能团进行标记后,切割N末端和随后的氨基酸。
巯基和二硫键测定
在肽图分析测序分析中,还应把游离巯基和二硫键考虑在内。用特定蛋白酶消化后的肽图分析,然后在还原前/还原后使用在线LC/ES-MS或LC/ES-MS/MS分析,可提供全面评估二硫键和游离基所需的mAb中的数据。
生物学活性-Biacore
在抗体体外生物学活行检测项目中,抗体与抗原、Fcγ受体、FcRn以及Clq的亲和检测均需采用Biacore技术进行申报。在美国FDA批准上市的70多种抗体药物中,80%都采用了Biacore技术完成了检测和申报,Biacore也成为了中美日三国药典收录的互作分析技术。
药效评价
抗体药的药效,不仅体现在Fab片段结合抗原的活性,还取决于其Fc片段,与Fcγ受体的相互作用,Fcγ受体的亲和力能够作为药物功效及半衰期的预测指标。2013年 ,Roche针对 CD20靶点的单抗Gazyva获批上市,用于慢性淋巴性白血病的治疗。在申报材料中,Biacore技术用于Fcγ受体结合活性的测定 , 结果显示Gazyva比美罗华有更好的Fcγ RIII结合能力。
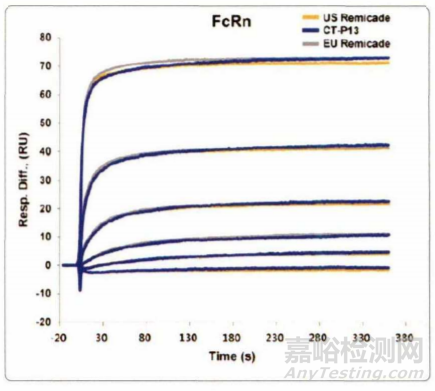
图2. Biacore 技术检测Inflectra和Remicade与 FcRn 的亲和结果图
一致性评价
一致性评价中关键一环是说明药 物的生物活性和原研药的相似性。在FDA生物类似药指南中,Biacore技术是结合测定的首推方法。众多企业在一致性评价中纷纷采用Biacore技术进行了申报上市,如Zarxio、Inflectra以及Benepali等。Biacore独创性地开了指纹图谱比对功能,利用其可以直接进行传感图细节比对并作出相似性打分,避免了由于拟合模型选择等操作带来的分析误差,使结果更加直观和准确。
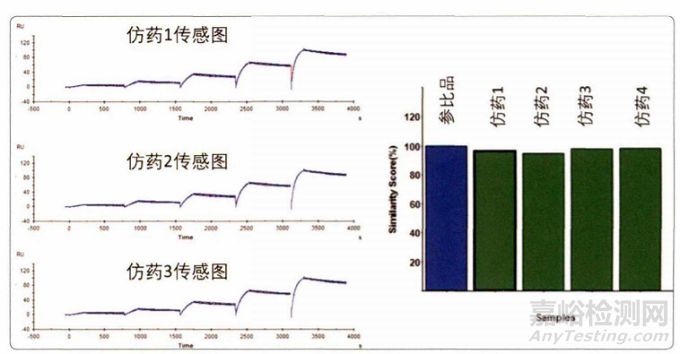
图3. Biacore平台独创性指纹图谱比对技术
生物活性质量控制
抗体药物由于分子量大 ,结构复杂,生物活性敏感,其工艺中每个环节的变化都可能导致产品质量出现差异。因此企业应 对抗体药物工艺流程中的关键质量属性(特别是生物活性) 进行实时监测、控制和放行。基于Biacore平台可以建立全面的质控标准,完成结合活性、活性浓度、翻译后修饰和杂质含量等的质量控制。Biacore平台可以实时监控各工艺流程组分中抗体的生物活性,如细胞培养 、过滤 、 澄清等 ,活性有问题的抗体会出现解离加快、结合信号降低的现象 ,以帮助企业快速发现工艺中的问题。Biacore技术还可以用于最终产 品的批次放行,例如金赛药业基于B iacore技术的生长激素蛋白批次放行标准获得了中国食品药品检定研究院审批通过。
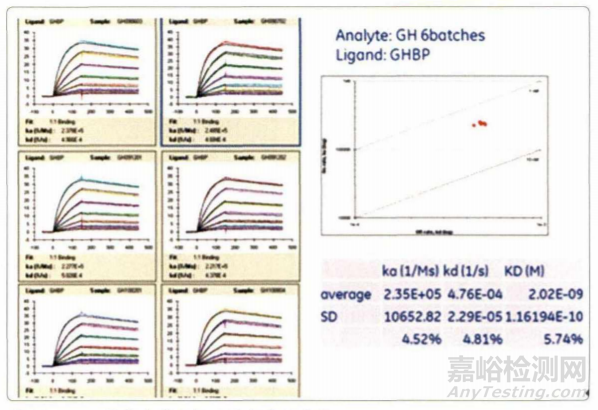
图4. Biacore技术在药物批次放行中的应用

来源:Internet


