您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-07-22 22:39
近年来,中国创新药研发蓬勃发展、高歌猛进。在全行业的努力下,中国创新企业让一切可成药的热门靶点研发在拼速度的比拼中内卷成了红海,也让中国患者有了全球最多的、经济的PD-1/PD-L1单抗可供选择。但也应看到国内创新研发的成功率仍处于低位,创新研发的产出率有待提高;创新医药研发的原创能力、转化研究能力仍有极大提升的空间。
根据近年来披露的研究数据,中国创新研发的整体成功率,特别是II期临床研究的成功率仍显著低于国际水平。通过对比2024年Nature Reviews Drug Discovery上的一篇文章对中国创新药在美国开展临床研发的成功率,以及BIO与QLS Advisors在2021年联合发布的报告披露的国际药企各研发阶段的成功率,可以发现中国创新药在美国开展的各临床研究阶段的成功率均显著低于国际水平,整体累计成功概率仅为国际水平的1/4(1.7% vs 7.9%),且II期临床成功率尤其显著低于国际水平(17% vs 28.9%)。
中国创新药在美研发各阶段成功率与国际水平的对比
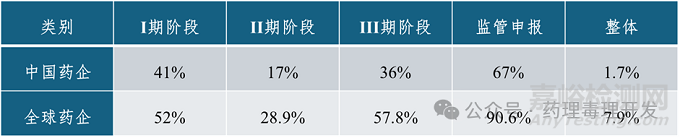
不论国内或是国外的创新药,II期临床阶段的研发成功率都是显著低于其他各阶段,且因有效性和安全性原因失败的项目约占3/4强。大部分情况下,II期临床试验是在患者体内首次开展的系统的POC研究。这就决定了II期试验本身就是在探索中找寻出路,在反复中柳暗花明,天生就具有较大的不确定性。根据既往文献的回顾分析,II期临床中失败的原因主要是有效性问题(近年来占比约为50%),其次为安全性问题(约占1/4)和策略性原因(约占1/4)。导致II期试验有效性不足的可能原因有:(1)靶点验证不充分,作用于靶点后并不能或不足以产生有临床意义的效果;(2)药物在靶部位的暴露不充分,表现为暴露水平低或有效暴露持续时间不足。因此,要解决造成II期临床研究的低成功率的问题还应向前回溯到早期研发阶段,从支持开展II期临床的靶点分子特性和早期临床研究数据中总结经验、寻找规律。
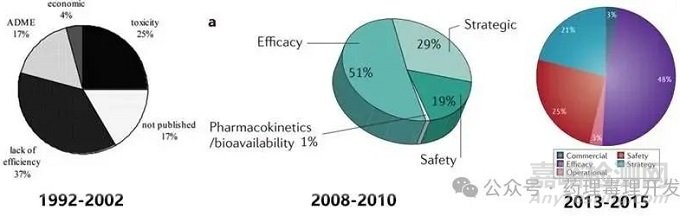
历年来II期临床失败原因分析
图片源自Curr Pharm Des. 2005;11(27):3545-59. Nat Rev Drug Discov. 2016 Dec; 15(12): 817-818. Nat Rev Drug Discov. 2011 May;10(5):328-9.
怎样提高创新药研发成功率?
怎样才能提高II期研究的成功率进而提升创新研发的效率呢?阿斯利康在2011年前后就通过提出5R原则为这一问题提出了解决思路。2005-2010年,阿斯利康的II期临床阶段的成功率仅为15%,大大落后于其他药企的29%,且主要失败的原因为有效性不足。为了改善公司研发产出率低的问题,阿斯利康在2011推动了研发策略变革,提出了5R研发理念,并基于这一理念开展全方面的研究并全面评估在研管线的研发成功率。5R原则中的Right target对靶点与临床疗效的相关性及可转化性提出了要求,确保靶点选择正确;Right tissue明确了药物需在靶组织有合适的暴露和产生药效作用强度及时长、强调了非临床及临床PKPD关系证据,确保药物充分作用于靶点;Right safety要求对靶点作用机制有充分理解,且产品具有足够的安全窗、相对较低的脱靶、代谢致毒及基因毒性风险,确保用药安全;Right patients要求以获益-风险评估为基础、以生物标志物为导向选择对药物有最佳响应的患者以实现最大获益,确保临床有效、安全;Right commercial potential着眼于产品竞争态势,明确产品开发的差异化优势和可商业化潜力,找准市场定位,确保商业化成功。此外,阿斯利康在通过5R框架聚焦临床需求、科学决策的同时,也通过创建Right culture筑牢企业价值观体系以确保方向正确,实现了持久变革。Right Culture强调“Truth-seeking”以求真,保证研发决策基于真实的数据和科学逻辑的理性;推动为项目提出“killer question”以求实时发现问题、识别风险,进而通过进一步的研究评估合理控制风险。

阿斯利康提出并践行的5R原则
图源自Nature Reviews Drug Discovery volume 17, pages167–181 (2018)
通过这一变革体系,阿斯利康的研发成功率提升显著。在2012-2016年间,阿斯利康的II期研究阶段的成功率提升到了43%,远远高于业界同期的18%和阿斯利康在2005-2010年见的15%;从候选分子确定到上市的整体成功率在2012-2017年达到了19%,远远高于业界同期和阿斯利康在2005-2010年加间的4%。因此,通过科学、严谨的非临床和临床研究全面表征产品的PK、PD、有效性及安全性特征并据此开展严谨、理性的评估可以推动高临床价值优质项目快速推进,也可以及时停止不易成药的项目避免资源的浪费,最终实现在科学的研究和真实的数据的基础上对创新研发的不确定性的合理控制,从而提升研发成功率。
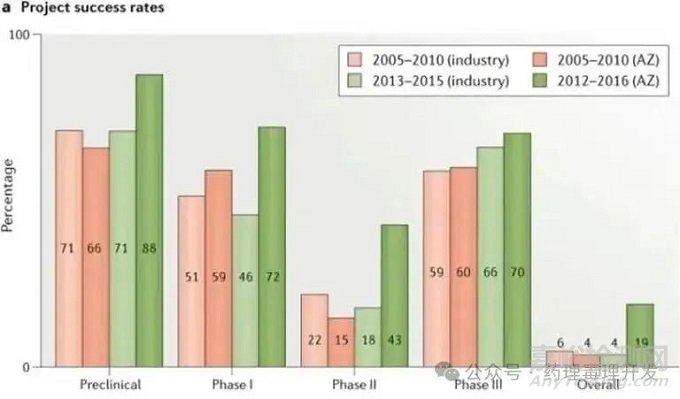
阿斯利康与全行业的各研发阶段在5R原则实施前后的成功率对比
图源自Nature Reviews Drug Discovery volume 17, pages167–181 (2018)
开展全面、有效的转化PK/PD研究的意义
5R原则只是一个关于产品评估要点的原则性文件,其各项与科学研究相关的原则需要在具体的临床前转化PK/PD研究中体现。近期,阿斯利康的早期研发部门对既往产品的转化PK/PD研究的情况进行了回顾性分析,明确了基于非临床研究数据的转化PK/PD研究在提升项目研发成功率方面的作用,主要发现如下:
转化PK/PD研究在提升创新研发成功率方面起关键作用,可通过确定可靠的go/no-go标准及优化实验设计加速研发决策;
非临床及转化PK/PD数据可有效预测患者体内药物-靶点相互作用的暴露-效应(ER)关系;
基于全面的非临床转化PK/PD研究数据,83%的分子预测的药物-靶点相互作用的ER关系在测定值的3倍以内(0.3-3);
实施全面的非临床转化PK/PD研究的项目在机制验证试验中的成功概率为85%,远高于开展基本非临床研究项目33%的成功率;
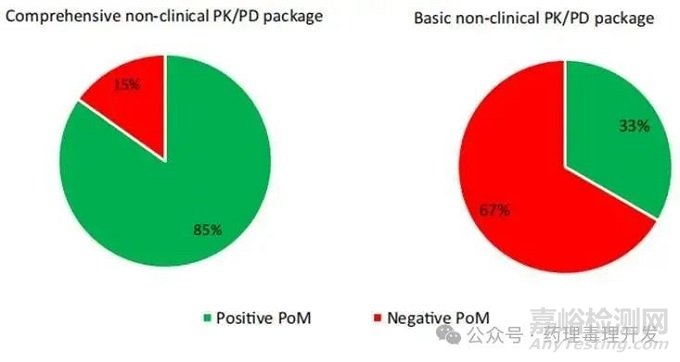
全面非临床PK/PD研究和基本非临床PK/PD研究的POM成功率对比
图片源自Drug Discov Today. 2025 Jul;30(7):104417.
基于非临床及转化PK/PD模型研究数据可以确定产生临床活性所需的靶点作用的强度和时长,以及在人体产生预期的靶点作用所需的暴露水平和剂量。这一非临床转化PK/PD研究的框架正是对5R原则中的Right target、Right tissue和Right safety的阐释,而非临床研究中关于预测性biomarker的研究也可为临床选择Right Patients提供探索方向。全面的非临床转化PK/PD研究研究的主要目标有两个:(1)以扎实、可靠的非临床研究数据指导临床设计出可高效执行的方案(如准确、合理的剂量、给药方案、PK/PD/Biomarker采样点等);(2)提升项目临床开发的成功率及促进早期go/no-go决策的科学、高效。此外,基于全面的非临床转化PK/PD研究数据,可实现准确及可靠地预测人体剂量-PK/PD关系,进而促进临床各阶段的快速决策、推进,加快临床开发进程;可以设计更合理的毒理试验计划和方案,高效支持上市申请;可以准确制定CMC研制计划及物料采购计划,节约经费、提升效率;也可为准确预估商业化前景提供支持,进而促进准确评估产品开发价值。因此,基于这一框架产生的数据可以作为临床剂量递增试验设计、设置基于PK或PD指标的项目go/no-go标准(包括POM试验在内地各早期研发阶段)和开展剂量及给药方案优化的依据,更高效推进创新项目的早期临床研发及决策。但现实中,有不少企业仅开展以支持IND报批为目的的非临床研究,不关注现有数据是否能开展转化PK/PD分析以支持临床更高效开展。当未获得充分的临床前和转化PK/PD研究数据时,只能单一的依赖在早期临床试验中有限例数的患者中获得的高异质性的数据进行早期临床研发阶段的go/no-go决策。考虑到临床研发阶段研究费用较高且患者个体差异较大,这种决策模式费时费力,且一般受限于样本量,并不能给出高质量的决策依据。
因此,基于全面地非临床PK/PD研究地数据对人体地PK/PD关系、有效暴露水平和剂量进行预测可以使临床地探索更有针对性、更高效。但每位从事新药研发的同仁都能理解到:基于非临床PK/PD数据预测临床剂量及PK/PD关系存在较大的不确定性,预测结果可能存在较大的偏差。产生这些偏差的原因主要有两方面:(1)科学层面,主要是非临床研究中使用的体外及动物实验体系是否与人体真实情况相关,也即非临床研究的获得的PK/PD研究结果是否可以外推到人体;(2)实施层面,是否有全面表征PK/PD关系的非临床研究数据可以用来预测人体PK/PD关系。理想的情况下,若项目可使用与人相关的试验体系阐明PK/PD关系且基于全面的非临床数据及转化PK/PD研究明确了产品的临床前PK/PD关系及转化的不确定性,预测的人体PK/PD关系可以达到较高的成功率(85%,阿斯利康数据);而若无与人体相关的非临床试验体系且只完成了支持IND报批的基本的非临床PK/PD研究,则预测的人体PK/PD关系成功的概率必然很低(33%,阿斯利康数据)。
当然,也会有项目仅开展了简单的IND报批研究但预测准确的案例。但随着创新转向更早的fast-follow或原创性创新,这种偶然为之的幸运必然敌不过概率分布的碾压,最终也会随着案例的累积回归低准确率的平常。此外,完成了全面的非临床PK/PD研究可以让POM试验成功的概率大幅提高,并不能确保项目一定在POM试验中成功。但全面的非临床PK/PD研究可有助于设定清晰的PK或PK/PD go/no- go标准以便在早期研发中更高效的决策是否继续开发,避免长期费时费力的探索和关键决策时的茫然无措、犹豫徘徊。从事创新研发,需要在平衡风险、速度的同时,基于对前期数据的全面理解去识别风险、控制风险,而非淡化风险乃至掩耳盗铃般无视风险、遮盖风险,或寄希望于命运垂青、手气爆棚。只有通过充分表征靶点特性和产品的非临床PK/PD特征、获得扎实的数据并为每个研发阶段设定清晰明确的go/no go标准才能更高效推进项目研发、提升创新项目临床开发成功率。目前,阿斯利康在2020-2021年的研究项目均推行了全面的非临床PK/PD研究的策略。
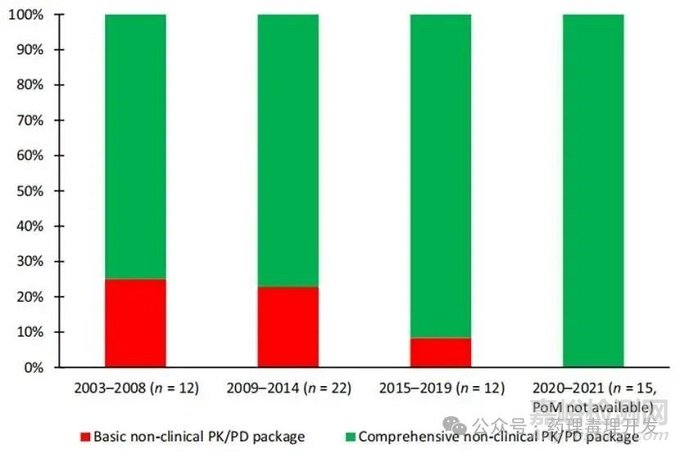
阿斯利康已在所有创新项目中推行全面非临床PK/PD研究
图片源自Drug Discov Today. 2025 Jul;30(7):104417.
怎样才算全面的非临床PK/PD研究?
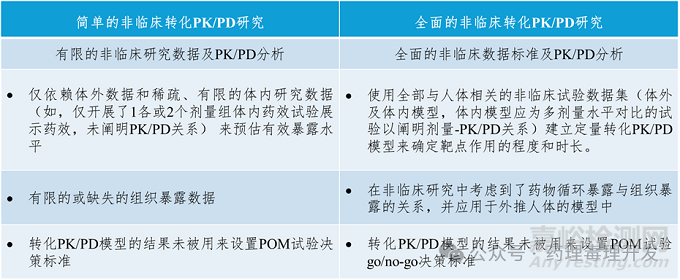
全面的非临床转化PK/PD研究应基于与人体相关的体外及体内模型开展研究,获得非临床PK/PD关系数据并外推到人体以支持临床方案设计和产品开发决策。对于非临床的体外、体内药效研究,很多人单纯从生物学、药效学的角度,以观察到药效作用为目标设计体外、体内药效试验,多忽略了对剂量-PK/PD关系、PD及生物标志物和药物在靶部位的暴露强度和时长的考察。忽略对影响药效的物质基础、量效关系及相关药效学标志物/生物标志物的考察就无法准确预估人体的有效暴露水平和剂量,也无法针对性的在临床监测相关标志物进行PK/PD关系分析。此外,转化PK/PD模型的建立过程是对既往非临床PK/PD数据进行建模求解的数学运算过程,其模型结构和模型分析的准确性严重依赖输入的非临床研究数据。若用于建模的非临床数据存在未知系统偏差、质量不高、PK/PD关系或量效关系不清以及靶点分布/药物暴露存在种属间差异,则转化PK/PD模型给出的结果也不会准确。因此,全面的非临床转化PK/PD研究需要基于靶点和产品的特点,选择与人体相关程度高的体外及体内模型阐明产品的剂量-PK/PD关系并探索药效学标志物和生物标志物,然后基于获得的高质量的非临床数据建立转化PK/PD模型后才能相对准确地外推人体的剂量-PK/PD关系。
虽然,数据越多,转化的成功概率越高,但创新研发毕竟必须平衡质量和速度的关系,不可能投入海量的资源搞清转化研究的方方面面。全面的非临床转化PK/PD研究不是面面俱到的研究,而应聚焦影响产品临床转化的关键问题开展揭示风险的试验并针对性进行风险的识别和管控,进而提出尚未解决或验证的问题作为进入下一阶段的风险考量用于产品开发决策。
不同非临床转化PK/PD研究特征的对比
总结
每一名从事新药研发的同仁都渴望通过自己的努力研发出能切实给患者带来获益的新药。选择正确的策略方法能更容易地让我们找对努力的方向,进而收获丰硕的成果。
对于me-too类药物来说,参照同类药物研发经验快速推进很重要,简单的非临床转化PK/PD研究可能已然满足要求,但全面的非临床转化PK/PD的研究可能仍对临床开发的快速开发提供便利;
对于me-better药物来说,通过全面的非临床转化PK/PD的研究可有助于发现潜在的有效性或安全性的竞争优势,且可基于充分的转化PK/PD数据支持临床开发的简化设计,更高效推进临床开发;
对于无可参照数据的fast-follow或FIC项目来说,扎实开展全面的非临床PK/PD研究,凭借对靶点及产品PK/PD关系的理解寻找迭代升级策略优中选优,可使项目在这个内卷的时代更易胜出。
创新研发是高风险工作,但高风险并不代表风险不可被预知、不可被探查、不可被化解。全面的非临床PK/PD研究就是识别创新药开发风险的关键利器。千万不能以高风险为借口放任风险存续进而放弃当下可以创造精品更新迭代的机会,更应该以积极的态度对自己提出“killer question”以提前解决问题、建立优势。
在转化研究中求索,在求索中进化,以逢山开路、遇水架桥的态度必然到达理想的彼岸。
参考文献:
Nat Rev Drug Discov. doi: 10.1038/d41573-024-00079-3.
Nature Reviews Drug Discovery. doi:10.1038/d41573-021-00190-9
Curr Pharm Des. 2005;11(27):3545-59.
Nat Rev Drug Discov.2016 Dec;15(12):817-818.
Nat Rev Drug Discov. 2011 May;10(5):328-9.
Drug Discov Today. 2025 Jul;30(7):104417.

来源:药理独立开发


