今日头条
歌礼FASN抑制剂上痤疮III期临床。歌礼制药口服脂肪酸合成酶(FASN)抑制剂ASC40(地尼法司他)治疗中、重度寻常性痤疮的III期临床完成首例患者给药。在II期临床中,与安慰剂相比,ASC40(25mg、50mg、75mg)显著降低患者第12周总皮损计数,降幅分别达到53.1%、61.3%和53.1%(vs34.2%);ASC40在所有剂量下的安全性和耐受性良好,药物相关不良事件发生率与安慰剂相当。
国内药讯
1.倍而达三代EGFR-TKI报产。倍而达药业1类化药瑞齐替尼胶囊的上市申请获NMPA受理。瑞齐替尼(BPI-7711)是一款不可逆、高选择性的第三代小分子表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),对EGFR敏感突变及EGFR T790M耐药突变具有显著的抑制活性。此前公布于ESMO2022年会上的IIa期临床结果显示,瑞齐替尼一线治疗局部晚期、转移性/复发性EGFR基因敏感突变的非小细胞肺癌(NSCLC)疗效显著,中位PFS超过20个月。
2.维亚臻siRNA疗法完成降血脂III期临床入组。维亚臻生物小干扰RNA(siRNA)药物VSA001注射液治疗中国家族性乳糜微粒血症综合征(FCS)III期临床完成全部患者入组,预计明年第一季度完成全部终点评价。VSA001可通过有效且持久地沉默载脂蛋白C3的信使RNA(APOC3 mRNA)来降低APOC3蛋白水平表达。去年9 月,CDE已将该新药纳入突破性治疗品种,用于降低FCS患者的甘油三酯水平。
3.博奥信SIRPα单抗获批抗肿瘤临床。博奥信SIRPα单抗BSI-082获FDA临床许可,即将在美国开展新药研究。BSI-082特异性结合SIRPα和SIRPβ,但不结合SIRPγ,能有效阻断SIRPα与CD47相互作用向巨噬细胞发出“别吃我”信号,从而使巨噬细胞和树突状细胞恢复对肿瘤细胞的吞噬作用。临床前研究显示,BSI-082具有与广泛抗肿瘤药物联合用药的潜力,可以进一步增强抗肿瘤药物对血液肿瘤与实体瘤的杀伤效果。
4.凡恩世DLL3/CD47双抗报IND。凡恩世制药1类生物制品PT217的临床试验申请获CDE受理。PT217是一款潜在“first-in-class”靶向DLL3和CD47的双特异性抗体,用于治疗小细胞肺癌和其他神经内分泌癌。PT217可通过巨噬细胞的吞噬作用(ADCP活性)和自然杀伤细胞的细胞毒作用(ADCC活性)直接杀伤肿瘤细胞,并通过同时靶向肿瘤细胞表面过度表达的DLL3和CD47,扩大肿瘤杀伤范围。
5.勤浩KIF18A抑制剂美国获批临床。勤浩医药KIF18A抑制剂GH2616获FDA临床批件。GH2616靶向在细胞分裂过程中调控染色体定位及纺锤体长度的蛋白KIF18A,与染色体不稳定(CIN)及基因组倍增(WGD+)构成协同/合成致死。在临床前CIN移植瘤模型研究中,GH2616单药显示出积极的抗肿瘤疗效,具备治疗脑部肿瘤及脑转移适应症的潜力。今年年初,该新药已在国内获批实体瘤临床。
6.康宁杰瑞/思路迪PD-L1抗体海外授权。康宁杰瑞与思路迪医药发布公告,宣布与Glenmark就皮下注射PD-L1抗体恩沃利单抗达成许可协议,Glenmark获得恩沃利单抗在印度、亚太(新加坡、泰国及马拉西亚除外)、中东及非洲、俄罗斯、独联体国家及拉丁美洲的肿瘤适应症独家许可及再授权。根据协议,Glenmark将支付总计7.008亿美元的预付款及里程碑金额,以及产品的销售分成。康宁杰瑞保留全球范围内而生产KN035的独家权利;思路迪医药保留在该地区以外于肿瘤领域的开发及商业化KN035的权利。
国际药讯
1.外用JAK抑制剂湿疹头对头临床成功。LEO Pharma公司JAK抑制剂Delgocitinib乳膏治疗慢性手部湿疹的III期DELTA FORCE(LP0133-1528)研究达到主要终点和所有关键的次要终点。与阿利维A酸胶囊组相比,Delgocitinib乳膏组第12周时患者手部湿疹严重性指数(HECSI)评分显著降低;研究者整体评估-慢性手部湿疹(IGA-CHE)得分为0或1且得分较之前至少改善2分的患者比例显著更高;该组不良事件(TEAE)发生率也更低。
2.钌基小分子新药结直肠癌Ⅱ期临床积极。Bold公司在2024ASCO GI年会上公布其基于钌基的潜在“first-in-class”小分子药物BOLD-100联合FOLFOX化疗方案治疗晚期转移性结直肠癌的Ⅱ期临床积极数据。BOLD-100联合治疗达到76%的疾病控制率,患者的中位无进展生存期为3.9个月(CI:2.7–5.7),中位总生存期为9.6个月(CI:6.0–17)。BOLD-100与FOLFOX方案耐受性良好,而并未发现新的安全性信号。
3.礼来FIC内耳疾病基因疗法早期临床积极。礼来旗下Akouos公司拟开发用于治疗因耳铁蛋白基因(OTOF)突变而导致感音神经性听力丧失患者的基因疗法AK-OTOF,在Ⅰ/Ⅱ期临床AK-OTOF-101中获得积极结果。首例受试者接受单侧耳蜗内AK-OTOF的单次给药30天后,听力恢复并达到65至20分贝听力级的阈值。AK-OTOF耐受性良好,没有严重不良事件的报告。此前,FDA已授予AK-OTOF孤儿药资格和罕见儿科疾病认定。
4.FDA要求获批CAR-T疗法添加黑框警告。经过两个月对CAR-T疗法继发性癌症风险的进一步调查,FDA日前发布公告,要求吉利德(Yescarta和Tecartus),诺华(Kymriah),百时美施贵宝(Breyanzi和Abecma),以及强生/传奇(Carvykti)需要在已获批CAR-T疗法的标签上添加黑框警告,标注存在继发癌症风险。涉及的药企必须在30天内作出回应,按要求调整,或提交异议报告。
5.新机制蛋白降解药物临床前研究积极。Amphista公司新型双功能靶向蛋白降解剂在临床前研究中获积极结果。在多种体内疾病模型中,每日一次口服剂量显著减少肿瘤负担;在100倍DC50剂量下,与8000多种其他蛋白质相比,靶标蛋白的降解达到统计学显著性。此外,该公司针对多个靶标蛋白设计的降解剂已实现CNS渗透,经静脉给药后,在动物模型中快速实现大脑中靶标蛋白的降解。
6.肿瘤学药物公司Synnovation完成A轮融资。Synnovation公司宣布完成1.02亿美元的A轮融资,以用于支持其主导项目高脑渗透性PARP1抑制剂SNV1521的临床开发,以及推进突变选择性PI3K-α抑制剂SNV4818等项目。SNV1521目前正在启动一项Ⅰ期临床试验,预计在未来几周内对首例患者进行给药。此轮融资由Third Rock Ventures领投,Nextech、礼来亚洲风险投资公司、Sirona Capital和Cormorant Asset Management跟投。
医药热点
1.中国首个WHO伤害预防控制合作中心成立。1月15日,中国疾控中心获批中国首个世卫组织(WHO)伤害预防控制合作中心,WHO认证中国疾控中心慢病中心伤害防控与心理健康室为世界卫生组织伤害预防控制合作中心,段蕾蕾研究员担任合作中心主任,这也是中国疾控中心慢病中心受WHO认证的第二个世界卫生组织合作中心。该合作中心的成立,将进一步提升中国在全球伤害预防控制领域的地位和影响力。
2.全国将年增社区医院超500个。近日,国家卫健委发布《“优质服务基层行”活动和社区医院建设三年行动方案》指出,到2025年,服务人口超过1万人的乡镇卫生院和社区卫生服务中心普遍达到能力标准,全国达到推荐标准的机构达到20%以上,其中东、中、西部省份分别达到30%、20%和10%以上。全国每年新增社区医院500个以上,力争到2025年全国累计建成社区医院的社区卫生服务中心比例达到30%以上。
评审动态
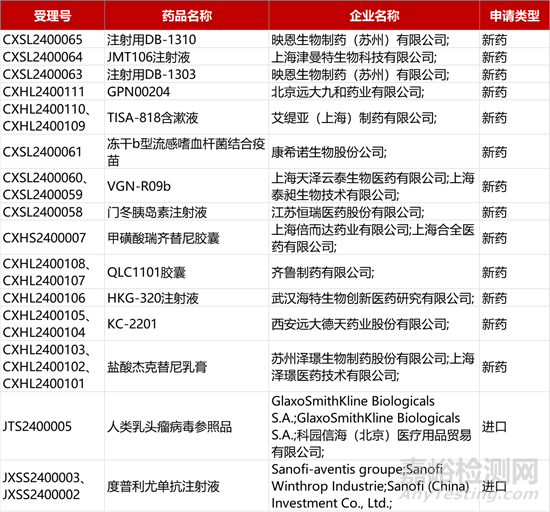
1. CDE新药受理情况(01月25日)
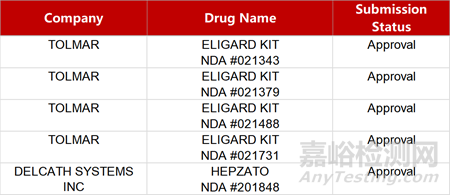
2. FDA新药获批情况(北美01月23日)