一、 背景
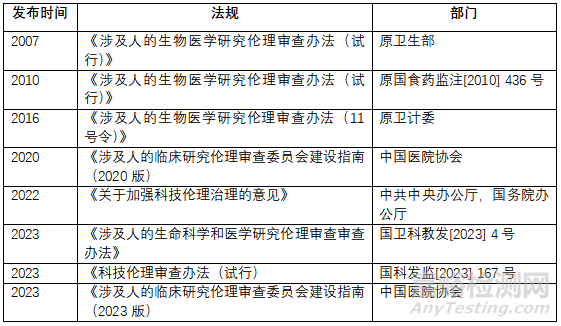
药物开展临床试验需要经过IND和伦理审查的双重同意方可开展进行,IND由药监机构负责审批(国内已实行默示许可制度),伦理审查一般由研究机构设立的伦理委员会把关。关于伦理审查有关的法规,从2007年的《涉及人的生物医学研究伦理审查办法(试行)》至今已有9部相关法规意见等发布。
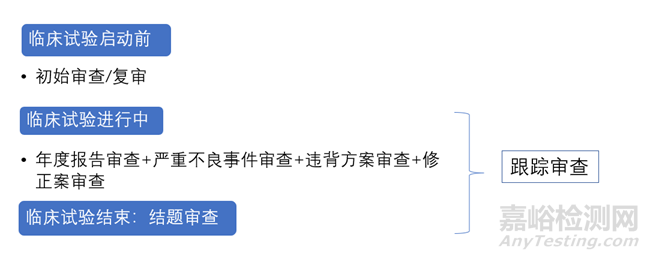
本文将关注涉及人的药物临床试验的伦理审查的内容。临床试验的伦理审查包括三个阶段:临床试验启动前、临床试验进行中和临床试验结束。
本文中的伦理审查指临床试验启动前的审查,该阶段的伦理审查目的是通过伦理,开展临床试验。
二、 伦理审查关注内容
伦理审查的主要目的保证受试者尊严、安全和权益,重点关注临床方案设计的科学性、伦理和理性等, 对于临床研究项目,伦理审查主要包括以下内容,现罗列主要内容,其他详见法规。
(1)研究者的资格、经验是否符合临床研究的要求;
(2)研究方案是否符合科学性和伦理原则的要求;
(3)受试者可能遭受的风险程度与研究预期的受益相比是否合理;
(4)在获取知情同意过程中,向受试者或其法定监护人提供的有关
信息资料是否完整通俗易懂,获得知情同意的方法是否适当;
(5)对受试者的信息和资料是否采取了保密措施;
(6)受试者入选和排除的指南是否合适和公平;
(7)是否向受试者明确告知他们应该享有的权利,包括在研究过程中他们可以随时退出研究而无须理由,且不因此而受到不公平对待的权利;
(8)受试者是否因参加研究而获得合理补偿,如因参加研究而受到损害甚至死亡时,给予的治疗以及赔偿措施是否合适;
(9)研究人员中是否有专人负责处理与知情同意获得过程和受试者安全相关的问题;
(10)对受试者在研究中可能承受的风险是否采取最小化的措施;
(11)研究人员与受试者之间是否存在可能会影响研究人员专业判断的利益冲突
三、 伦理审查流程
关于伦理审查流程,分为初始审查和复审两大步骤,初审不通过时,对不合格的地方进行修正之后再进行复审申请。总体上包括申请递交-受理-形式审查-会议审查/快速审查-审查意见-签发批件/不同意等步骤,但是伦理审查具体的权限由医疗机构的伦理委员会实施把握,所以落实到每个伦理委员会会有不同,申请递交的资料清单模板等以医疗机构发布的为准。
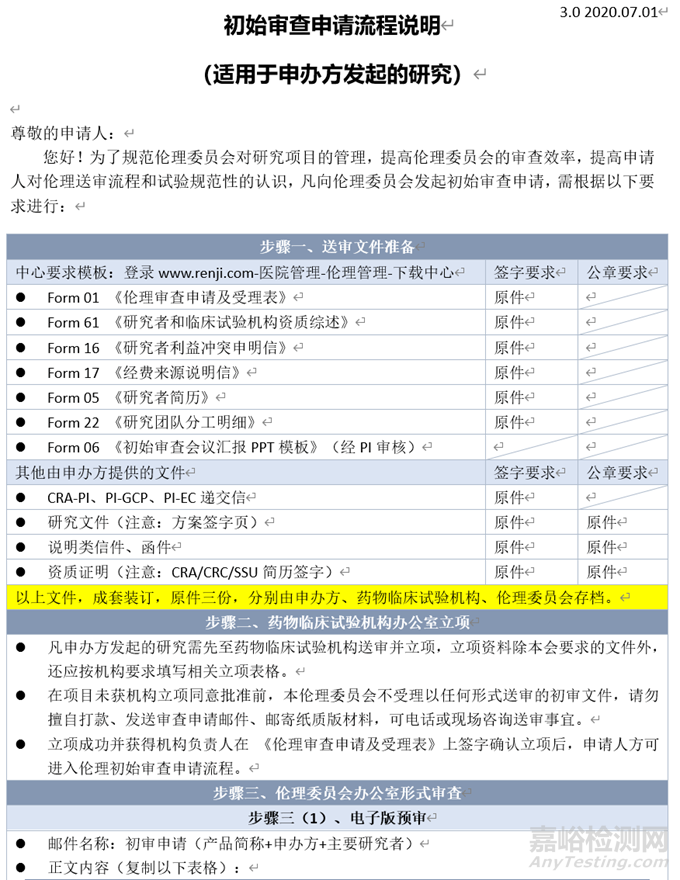
本文以仁济医院为例,伦理审查初审的流程如下:
步骤一:送审文件准备;步骤二:药物临床试验机构办公室立项;步骤三:伦理委员会办公室形式审查:步骤三(1)电子版预审,步骤三(2)纸质版受理;步骤四:初审费用支付;步骤五:接受伦理审查;步骤六:审查决定获取等。
四、 递交文件准备
递交文件准备包括递交文件的清单和递交文件的模板填写,如上文所诉,具体文件准备以伦理委员会的要求为准,以仁济医院为例。首先登陆仁济医院官网,点击医院管理下的伦理管理,进入伦理管理页面。
伦理管理包括院内科研和注册临床两种。
点击规范流程
可以发现,注册临床有初始审查流程、复审申请流程、安全性报告送审流程。点击初审审查流程(复审同理),为申请人提供的详细说明初始审查申请的word文件。
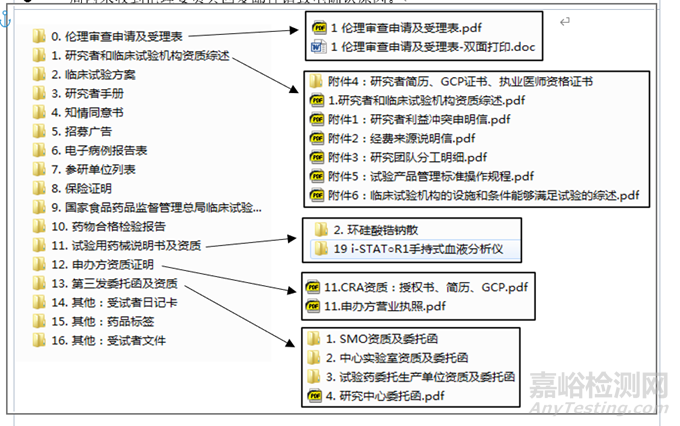
该文件对于流程步骤以及需要提交的文件都有详细说明。
对于递交的文件,伦理委员会对有的文件会提供模板,该部分文件必须按照模板进行填写准备,可以在下载中心中下载。
对于下载中心未提供的文件模板,可以由申办者自行准备。
五、 总结
关于伦理初审审查的流程以及文件递交的要求,不同的伦理委员会可能会有差异,本文仅以仁济医院的伦理委员会为例进行演练,具体到不同的项目,方法基本相同。