您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-20 05:50
摘要:以药物的作用机制为基础,采用细胞与分子生物学技术构建特定基因修饰细胞系并开发相应的检测方法,可用于相关产品的生物检定。这种基于基因修饰细胞系的生物检定法在药物的质量控制领域具有广泛的应用前景。本文探讨了基因修饰细胞系的构建策略及检测方法的基本原理,并概述了基于基因修饰细胞系的生物检定法在重组蛋白类、疫苗类、基因治疗类等不同产品质量评价中的研究进展及应用情况。
关键词:基因修饰细胞系;生物检定法;细胞法;报告基因法;活性/效价测定
Abstract: Based on the mechanism of action of drugs, specific gene modified cell lines are constructed using cell and molecular biology technologies, and corresponding test methods are developed, which can be used for biological assays of related products. These genetically modified cell based bioassays have a wide application prospect in the field of pharmaceutical quality control. In this paper, the construction strategies of genetically modified cell lines and the basic principles of detection methods are discussed, and the research progress and application of genetically modified cellbased bioassays in the quality evaluation of recombinant proteins, vaccines, and gene therapy products are summarized.
Key words: genetically modified cells; bioassays; cellbased bioassays; reporter gene assays;bioactivity/potency determination
生物检定法是利用生物体包括整体动物、离体组织、器官、细胞和微生物等评估药物生物活性的一种方法。《中华人民共和国药典》(简称《中国药典》)2020年版三部通则中共收录36个品种的39种生物活性/效价测定法,其中动物法15种,基于原代血液细胞/血清的方法9种,基于细胞系的方法13种(其中两种为报告基因细胞系),生化试验2种[1]。目前动物法主要用于疫苗类制品的效价测定,重组蛋白质/多肽类药物多采用细胞法。
依赖于实验动物的方法操作繁琐,变异度大,且目前国际上推行实验动物“3R”原则[减少(reduction)、替代(replacement)和优化(refinement)],《中国药典》2020年版三部凡例二十五项也提出“应尽量采用准确的理化分析方法或体外生物学方法取代动物试验进行生物制品质量检定,以减少动物的使用。”因此,各国监管部门和药品生产企业都在积极尝试减少动物实验,在放行检验中采用基于细胞系的检测方法(cellbased bioassay)。随着基于细胞系的生物检定法的应用日益广泛,早期的动物试验逐渐被细胞试验所替代。细胞法一般通过检测细胞表型变化,如增殖、凋亡等来测定生物活性,但是表型变化一般需要2~7 d,或者变化不明显,加上药物受体分布的组织器官特异性,通常难以获得合适的活性测定用细胞。因此,目前某些生物检定仍需依赖于动物实验,或现有的细胞法存在缺陷,尤其是很多创新生物技术药,如endostatin等,目前仍未解决活性测定难题。
采用细胞和分子生物学技术对初始细胞进行有目的的基因修饰,建立药物反应性的细胞模型,并开发相应的活性检测方法,可用于生物学活性测定等生物检定。报告基因法是目前最常用的方法,报告基因是一种编码易被检测的蛋白质或酶的基因,如绿色荧光蛋白、荧光素酶等,将药物特异的DNA反应元件与报告基因结合后导入初始细胞,检测药物作用后报告基因表达的变化来测定活性,这种方法快速简便,一般数小时内即可完成检测。《中国药典》2015年版收录了干扰素报告基因法,这也是国际上首例药典收录的基于基因修饰细胞的活性测定方法,《中国药典》2020年版又收录了康柏西普的报告基因测活方法[1]。目前这种基于基因修饰细胞系的生物检定法应用日益广泛,不仅涉及细胞因子类、激素类、单克隆抗体类、疫苗类、基因治疗类等多种产品的活性/效价测定,还扩展到某些活性杂质的检测(表1)。为了规范和指导基于基因修饰细胞系的生物检定法的开发和应用,在国家药典委的资助下,由中国食品检定研究院牵头组织相关领域的专家起草了“基于基因修饰细胞系的生物检定法”通则,目前处于公示阶段。本文通过概述基于基因修饰细胞系的生物检定法的研究现状及应用情况,对通则内容进行深入解读。
1 细胞法基本原理
细胞法是基于待测物的主要作用机制,包括作用位点、胞内信号通路及效应分子,结合临床相关性,选择响应值高、易检测的信号分子或效应分子作为检测指示物。作用位点是指待测物结合并发挥作用的蛋白或其他分子,如受体或配体;胞内信号通路涉及受体的活化、级联反应的酶类、信号分子等,例如环腺苷酸(cAMP)、环鸟苷酸(cGMP)、Ca2+、转录因子等;效应分子一般包括各类效应蛋白,例如酶类、细胞因子等;临床相关性即某个信号通路与待测物发挥临床效能的相关性,通常胞内信号通路都不是单一的,每条信号通路产生的效应可能并不相同,可能跟细胞增殖、细胞分化或细胞迁移相关,因此要考虑其临床相关性;检测指示物即实施终点检测的目标分子,其含量与待测物的活性呈相关性,可能是正相关也可能是负相关,通常会选择酶类进行检测,因为酶促反应具有放大性,可以产生更高的响应值,例如常规的细胞增殖和凋亡试验采用氧化磷酸化相关的酶作为检测指示物,加入显色染料(MTT、MTS等)后采集光信号值。
2 基因修饰细胞系
敏感性细胞系是生物检定法的前提,当无法获得满足检测需求的细胞时,例如待测物作用位点表达量低或无适宜检测指示物时,可以通过基因修饰的方式构建检测用细胞。
2.1 构建策略
根据待测物的作用特性和初始细胞的不同,可以采用不同的构建策略,最终的目的都是优化方法的灵敏度和信噪比,从而达到提高检测准确度和重复性的效果。通常考虑增强细胞的灵敏度和信号强度,前者可以通过增加待测物作用位点表达量的方式,后者可以通过导入新的检测指示物(如报告基因)或改造胞内信号通路的方式。下面对常用的构建策略进行分类梳理。
2.1.1 增强细胞反应性 当初始细胞存在适宜的检测指示物,但细胞对待测物反应不敏感(作用位点缺失或表达不足),可通过直接导入作用位点等方式增强其反应性,如,脑利钠肽受体为鸟苷酸环化酶,与脑利钠肽结合后,可激活胞内的鸟苷酸环化酶活性催化GTP转化为cGMP,cGMP生成量与脑利钠肽活性呈正比。HEK293细胞本身不表达脑利钠肽受体,将脑利钠肽受体表达载体转染入HEK293细胞,通过ELISA检测cGMP的含量,可用于测定脑利钠肽生物学活性[2]。除了直接导入作用位点,也可以通过其他方式增强细胞反应性,例如增加信号通路中某个效应分子的表达,也可上调细胞的反应性。
2.1.2 导入检测指示物 当初始细胞缺少适宜的检测指示物,可根据待测物作用特点及胞内信号通路,向细胞内导入易于检测的指示物,常用的策略是报告基因法:当待测物作用位点表达适量并存在特异性激活的转录因子时,可将相应的DNA反应元件与报告基因序列结合并导入初始细胞,建立反应性报告基因细胞系。例如,将干扰素刺激反应元件(ISRE)荧光素酶报告基因导入HEK293细胞,通过检测荧光素酶表达量,测定Ⅰ型干扰素生物学活性[3]。也可通过改造胞内信号通路的方式导入检测指示物,以VEGFtrap为例,将 VEGFR1的胞外区分别与 IL18受体α(IL18Rα)和IL18 受体β(IL18β)的胞内区融合而成嵌合受体,并与NFκB 荧光素酶报告基因共同导入HEK293细胞,VEGFR1 与VEGF 结合后发生二聚化,使得 IL18Rα 和 IL18β胞内结构域相互作用,并传递信号,激活 NFκB 驱动的荧光素酶报告基因表达,而VEGFtrap可以剂量依赖性抑制VEGF诱导的萤光素酶表达[4]。
2.1.3 增强细胞反应性同时导入检测指示物 当初始细胞缺少适宜的检测指示物,且对待测物反应不敏感,可在增强细胞反应性的同时导入检测指示物。当存在特异性激活的转录因子时,可同时将待测物作用位点和相应的DNA反应元件报告基因导入初始细胞,建立反应性报告基因细胞系。例如,将胰高血糖素样肽1(GLP1)受体和cAMP反应元件(CRE)荧光素酶报告基因同时导入CHOK1细胞,通过检测荧光素酶表达量来测定GLP1及其类似物的生物学活性[5]。
2.1.4 其他策略 除了增加细胞的反应性,还可以改造细胞特性使细胞更加稳定,例如通过导入SV40大T抗原构建永生化细胞来解决原代细胞培养不稳定的缺陷。随着分子生物学技术的不断发展,双报告基因、生物传感器、互补荧光素酶、基因编辑等新技术新方法不断的应用到生物检定方法的开发中,解决更多检测难题。
双报告基因,即在一个细胞同时导入两个独立测量的报告基因,其中一个报告基因的表达与待测物浓度相关,而另一个报告基因的组成型表达提供内对照,可减少细胞活力、数量及裂解效率等内在因素造成的变异,使检测结果更加准确[6]。
生物传感器,将萤光素酶基因进行改造,加入胞内第二信使cAMP或cGMP的结合位点,与cAMP或cGMP结合后可发生构象改变而激活,催化底物产生化学发光,可用于G蛋白偶联受体类药物的活性检测[7]。
互补荧光素酶,把荧光素酶分成两部分NLuc和CLuc,然后将胞内信号通路中发生相互作用的蛋白A和B分别与NLuc和CLuc构成融合蛋白AnLuc和BcLuc,药物激活胞内信号通路后,A和B发生相互作用使NLuc和CLuc靠近形成完整的荧光素酶,通过检测荧光素酶活性反映药物活性[8]。
基因编辑,当药物的特异性受体和作用机制不明时,可采用基因编辑技术,对细胞进行随机改造,通过药物筛选,获得敏感性细胞,例如CRISPER/Cas9技术构建EGF依赖的检测用细胞[9]。
2.2 稳定性评价
为保证生物检定法的稳定性,基因修饰细胞系应建库管理,细胞库的建立、管理和质量控制可参照《中国药典》2020年版相关要求。如必要,在生长培养基中加入维持剂量的筛选试剂以防止外源基因丢失,保证基因修饰细胞的稳定性。基因修饰细胞的稳定性评价一般包括遗传水平和功能水平,前者可采用PCR的方法检测外源基因的拷贝数[10],采用免疫印迹、流式免疫荧光等方法检测目的蛋白的表达情况等进行评价[2],后者可通过细胞对待测物的检测灵敏度、信噪比等进行评价[11]。
3 基于基因修饰细胞系的生物检定法
基于基因修饰细胞系的生物检定法主要用于生物学活性、效价测定,也可用于某些杂质的含量测定,其方法建立和验证过程与传统细胞法类似。根据待测物的作用机制,选择特异性好、易检测的指示物及相应的检测方法。根据检测目的进行合理的实验设计,一般试验过程包括:细胞制备、样品溶液的制备、加样并孵育、目标指示物的检测。除少部分可直接检测的目标指示物(如荧光蛋白)外,间接检测的目标指示物,通常需加入特定的染料或底物,再进行信号采集,如光密度(OD)、化学发光或荧光信号。某些情况下,还需要采用酶联免疫吸附(ELISA)、PCR等更加复杂的方式检测目标指示物。通过合理的试验设计来确定细胞数量、待测物的作用浓度和范围、作用时间等关键试验参数,并参考《中国药典》2015年版通则9401“生物制品生物活性/效价测定方法验证指导原则”的相关要求进行方法学验证[1]。
根据检测方法,可分为直接法和竞争抑制法。以最常用的报告基因法为例,直接法是待测物直接作用细胞后,经过一系列信号传导和级联反应,激活DNA反应元件,启动报告基因表达,通过检测报告基因表达量的变化来测定供试品的生物学活性,多用于细胞因子类药物,如干扰素报告基因法[3];竞争抑制法是采用特定诱导物刺激细胞,激活报告基因表达,再加入待测物竞争性抑制报告基因的表达,多用于单抗类药物,例如IL6靶点抗体类药物的报告基因法[12]。
根据检测体系,可分为单细胞系统和多细胞系统。对于细胞因子类,通常采用单个细胞即可满足检测需求,而某些单抗产品需要采用双细胞报告基因系统。目前双细胞报告基因系统主要分为两类:1)基因修饰的效应细胞,以单抗的ADCC活性为例,FcγRIIIa/FcεRIγ融合受体与NFAT报告基因共同导入Jurkat细胞作为效应细胞,单抗药物与靶细胞表面抗原结合后可激活效应细胞内报告基因的表达[13];2)基因修饰的靶细胞和效应细胞,以PD1/PDL1靶点单抗为例,PDL1和antiCD3 scFv共同导入CHO细胞作为靶细胞,PD1和NFAT报告基因共同导入Jurkat细胞作为效应细胞,PD1与PDL1结合后抑制效应细胞激活引起的报告基因表达,而PD1/PDL1靶点药物可以剂量依赖性逆转这种抑制作用[14]。
4 应用举例
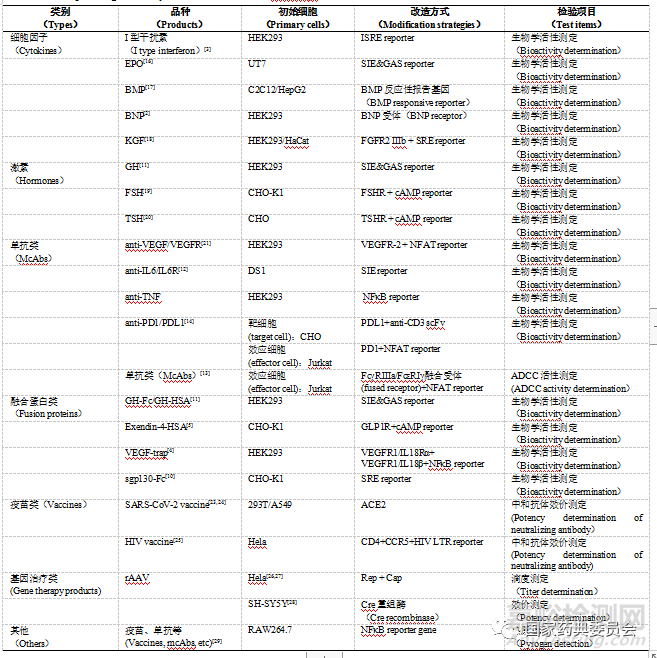
基因修饰细胞在药物研发和生产中应用非常广泛,从早期的药物筛选到后期的质量控制,都发挥着重要的作用。在生物检定领域,涉及品种包括细胞因子、激素、单克隆抗体、融合蛋白、基因治疗产品等多种药物,涉及项目除了生物学活性/效价、滴度测定,还扩展到某些活性杂质的检测(表1)[15]。
4.1 重组蛋白类产品的生物学活性测定
基因修饰细胞法最早应用于细胞因子类产品的生物学活性测定,后来逐渐应用到激素、单抗、融合蛋白等多种重组蛋白类产品的活性测定。目前已有多个研究建立了基于报告基因的替代或补充方法,用于替代早期的动物试验或提高原有细胞法的灵敏度和稳定性。例如目前药典收录的生长激素生物测定法为去垂体大鼠体重法和去垂体大鼠胫骨法,需要去垂体大鼠模型,已有研究建立基于报告基因的方法,将生长激素受体和特定的DNA反应元件报告基因同时导入HEK293细胞,建立的报告基因细胞系对生长激素类产品具有良好的剂量依赖效应[11]。由于单抗的作用特性,目前大部分单抗产品都采用了基于报告基因的竞争抑制法测定其活性,例如VEGF/VEGFR、IL6/IL6R、EGF/EGFR、PD1/PDL1等靶点的单抗制品,以及ADCC、ADCP活性[1214,21,22,30,31]。
4.2 疫苗类产品效价测定
中和抗体是评价疫苗免疫保护效果的一项重要指标,基本原理是将待测疫苗免疫敏感动物后,测定血清中特异性中和抗体的含量来反映疫苗效价。通常采用基于细胞的方法,观察待测血清能否抑制病毒的细胞病变效应(CPE)或病毒空斑形成等,为了减少生物安全风险,目前多采用假病毒进行测试[32]。由于某些病毒的培养特性,需要通过基因修饰的方式构建敏感细胞,例如,构建血管紧张素转化酶2(ACE2)过表达的293T细胞用于检测新型冠状病毒(SARSCoV2)的中和抗体效价[23];构建登革热病毒衣壳蛋白稳定表达的蚊子细胞结合改构的登革热报告基因病毒,用于检测登革热病毒中和抗体[24];构建多受体共表达的TZMbl(CXCR4+CD4+CCR5+)报告基因细胞系检测HIV中和抗体[25]。
表1 基于基因修饰细胞系的生物检定法应用举例
Tab.1 Examples of genetically modified cellbased bioassays
4.3 基因治疗产品的感染滴度及效价测定
目前很多基因治疗产品的质量评价都要用到基因修饰细胞系,以重组腺相关病毒(rAAV)为例,滴度检测方法为TCID50法,由于rAAV缺少复制必需的Rep、Cap基因,将Rep、Cap基因稳定转染至Hela细胞,当rAAV与辅助病毒共感染该细胞时,rAAV基因组就会进行复制,再通过QPCR检测基因组滴度,从而测定病毒感染滴度[26,27]。基因治疗产品的效价指标包括所携带目的基因的表达量和表达产物的生物学活性。靶向神经系统的rAAV产品一般会采用神经特异性的启动子,而很多神经特异性的启动子只有在Cre表达阳性的神经细胞才能被激活,常规用于评价的细胞系如HEK293并不适宜评价此类产品,已有研究构建了Cre重组酶稳定表达的神经母细胞瘤细胞系SHSY5Y,用来评价靶向神经系统的rAAV产品的效价[28]。目标基因表达产物的生物学活性可参考蛋白类产品活性测定方法,某些产品可能需要采用目标基因缺失的细胞模型来评价,可以通过患者供体细胞分离培养获得,也可通过基因敲除构建所需细胞模型。
4.4 其他应用
除了针对药效成分,基因修饰细胞系还可用于活性杂质的检测。已有研究者开发了基于报告基因的热原检测方法,NFκB是热原诱导的促炎作用的关键信号分子,将NFκB反应元件报告基因导入RAW264.7细胞建立报告基因细胞系,对不同来源的热原均有良好的量效反应,可用于包括疫苗、单抗在内的不同类型产品中的热原检测[24]。
5 总结
基于基因修饰细胞系的生物检定法可以解决多种检测难题,随着药靶作用机制的深入研究以及细胞和分子生物学技术的快速发展,可以根据药物作用机制及其临床相关性,更加自如的构建出满足检测需求的基因修饰细胞,并开发出灵敏、稳定的检测方法应用于药物的质量控制,以促进相关产品的质量标准提高,保障临床用产品的安全、有效和质量可控。
参考文献
[1] 中华人民共和国药典2020年版.三部[S]. 2020:577;ChP2020.Vol Ⅲ[S].2020:577
[2] YU L, RAO CM, SHI XC, et al. A novel bioassay for the activity determination of therapeutic human brain natriuretic peptide (BNP) [J]. Plos One, 2012, 7(11): e49934
[3] LAROCQUE L, BLIU A, XU R, et al.Bioactivity determination of native and variant forms of therapeutic interferons [J]. J Biomed Biotechnol, 2011, 2011: 174615
[4] 王兰, 饶春明, 李永红,等.血管内皮生长因子抑制剂生物学活性检测方法的建立[J]. 中国生物制品学杂志, 2009, 22(9): 895
WANG L, RAO CM, LI YH, et al. Development of a method for determination of biological activity of vascular endothelial growth factor trap[J].Chin J Biol, 2009, 22(9): 895
[5] 于雷, 范文红, 王兰,等. 报告基因法检测促胰岛素分泌肽融合蛋白生物学活性.药物分析杂志, 2016, 36(3): 426
YU L, FAN WH, WANG L, et al. Reporter gene assay for bioactivity determination of exendin4HSA[J].Chin J Pharm Anal,2016, 36(3): 426
[6] 刘红玲,林英,沈关望,等. 一种适于家蚕细胞激素研究的双荧光素酶报告基因系统的内参质粒的构建[J]. 生物工程学报,2018,34(10):1631
LIU HL, LIN Y, SHEN GW, et al. Establishment of a suitable control reporter plasmid of a dual luciferase reporter gene system for hormone research in silkworm cell lines [J]. Chin J Biotechnol, 2018, 34(10): 1631
[7] YU L, SHI XC, HAN CM, et al. A rapid reporter assay for recombinant human brain natriuretic peptide (rhBNP) by GloSensor technology [J]. J Pharm Anal, 2018, 8(5): 297
[8] WOLF F, LI WR, LI F, et al. Novel luciferasebased reporter system to monitor activation of ErbB2/Her2/neu pathway noninvasively during radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2011, 79(1): 233
[9] QIN X, YAO WR, SHI XC, et al. Responsive cells for rhEGF bioassay obtained through screening of a CRISPR/Cas9 library [J]. Sci Rep, 2019, 9(1): 3780.
[10] YU L, JIA CC, YAO WR, et al. Development and validation of a reportercelllinebased bioassay for therapeutic soluble gp130Fc [J]. Molecules, 2019, 24(21):3845
[11] YAO WR, YU L, FAN WH, et al. A Cellbased strategy for bioactivity determination of longacting fcfusion recombinant human growth hormone [J]. Molecules, 2019, 24(7):1389
[12] YU CF, CAO JX, WANG L, et al. Measuring the bioactivity of antiIL6/antiIL6R therapeutic antibodies: presentation of a robust reporter gene assay [J]. Anal Bioanal Chem, 2018, 410(27): 7067
[13] CHENG ZJ, GARVIN D, PAGUIO A, et al. Development of a robust reporterbased ADCC assay with frozen, thawanduse cells to measure Fc effector function of therapeutic antibodies [J]. J Immunol Methods, 2014, 414: 69
[14] WANG L, YU CF, YANG YL, et al. Development of a robust reporter gene assay to measure the bioactivity of antiPD1/antiPDL1 therapeutic antibodies [J]. J Pharm Biomed Anal, 2017, 145: 447
[15] WANG L, YU CF, WANG JZ. Development of reporter gene assays to determine the bioactivity of biopharmaceuticals [J]. Biotechnol Adv, 2020, 39: 107466
[16] YANG YS, ZHOU Y, YU L, et al. A novel reporter gene assay for recombinant human erythropoietin (rHuEPO) pharmaceutical products [J]. J Pharm Biomed Anal, 2014, 100: 316
[17] ZILBERBERG L, TEN DP, SAKAI LY, et al. A rapid and sensitive bioassay to measure bone morphogenetic protein activity [J].BMC Cell Biol, 2007, 8: 41
[18] YAO WR, GUO Y, QIN X, et al. Bioactivity determination of a therapeutic recombinant human keratinocyte growth factor by a validated cellbased bioassay [J]. Molecules, 2019, 24(4):699
[19] WANG LY, LIANG CG, YANG HM, et al. Development of a robust reporter genebased assay for the bioactivity determination of recombinant human follicle stimulating hormone (rhFSH) pharmaceutical products [J]. J Pharm Biomed Anal, 2020, 177: 112855
[20] SENDAK RA, WANG F, GEAGAN LB, et al. Comparison of two in vitro methods for the measurement of recombinant human TSH bioactivity [J]. Biologicals, 2002, 30(3): 245
[21] WANG L, XU GL, GAO K, et al. Development of a robust reporterbased assay for the bioactivity determination of antiVEGF therapeutic antibodies [J]. J Pharm Biomed Anal, 2016, 125: 212
[22] LEE HY, CONTRERAS E, REGISTER AC, et al. Development of a bioassay to detect Tcellactivating impurities for Tcelldependent bispecific antibodies [J]. Sci Rep, 2019, 9(1): 3900
[23] HU J, GAO QZ, HE CL, et al. Development of cellbased pseudovirus entry assay to identify potential viral entry inhibitors and neutralizing antibodies against SARSCoV2 [J]. Genes Dis, 2020, 7(4): 551
[24] JUNJHON J, PANYASU K, CHAIYALOOM S, et al. Generation and characterization of luciferasesecreting, singleround infectious DENV2 reporter for functional antibody assays [J]. J Virol Methods, 2021, 291: 114119
[25] OCHSENBAUER C, KAPPES JC.New virologic reagents for neutralizing antibody assays [J]. Curr Opin HIV AIDS, 2009, 4(5): 418
[26] LOCK M, WILSON J, SENAESTEVES M, et al. Sensitive determination of infectious titer of recombinant adenoassociated viruses (rAAVs) Using TCID50 endpoint dilution and quantitative polymerase chain reaction (qPCR) [J]. Cold Spring Harb Protoc, 2020, 2020(5): 95653
[27] ZEN Z, ESPINOZA Y, BLEU T, et al. Infectious titer assay for adenoassociated virus vectors with sensitivity sufficient to detect single infectious events. [J]. Hum Gene Ther, 2004, 15(7): 709
[28] KOPERA HC, HILGARTH RS, KOPAS TL, et al. Development and validation of a reporter cell line for rapid AAV quality control assessment [J]. MethodsX, 2020, 7: 100800
[29] HE Q, YU CF, WANG L, et al. A novel reporter gene assay for pyrogen detection [J]. JPN J Infect Dis, 2020, 73(2): 111
[30] KUHNS S, SHU J, XIANG C, et al. Differential influence on antibody dependent cellular phagocytosis by different glycoforms on therapeutic Monoclonal antibodies [J]. J Biothchnol, 2020, 317: 5
[31] WOLF F, LI WR, LI F, et al. Novel luciferasebased reporter system to monitor activation of ErbB2/Her2/neu pathway noninvasively during radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2011, 79(1): 233.
[32] 马建, 贺鹏飞, 赵晨燕,等.SARS和MERS中和抗体假病毒检测方法的建立[J]. 病毒学报, 2019, 35(02): 189.
MA J, HE PF, ZHAO CY, etal. Development of SARS and MERS neutralization methods based on pseudoviruses [J]. Chin J Virol, 2019, 35(2): 189
《中国药品标准》杂志 2022年第23卷第2期:于雷, 周勇, 王军志;(中国食品药品检定研究院, 卫生部生物技术产品检定方法及其标准化重点实验室, 北京 100050)

来源:Internet


