您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-30 17:01
口腔崩解片无需水或仅需少量水即可在口腔内快速崩解,可满足口服困难或处于特殊情况下患者的医疗需求,顺应性高。由于其独特性能,近年来对于口腔崩解片的研究越来越多,并逐渐成为一大热点。制备技术也从传统的粉末直接压片、冷冻干燥、湿法制粒等进一步发展完善,出现许多新的技术: 基于预混辅料的粉末直压、微波照射、3D 打印技术、固态溶液技术等。通过查阅大量相关文献,并结合口腔崩解片的国内外发展情况,本文旨在综述口腔崩解片的制备新技术及掩味技术,着重介绍了制备工艺的新进展和新突破,提出目前亟需解决的问题以及口腔崩解片的口感改善技术,为口腔崩解片的进一步研发提供依据。口腔崩解片的良好性能不仅为药物速释提供了新的解决思路,也为老人、幼儿及吞咽困难的特殊疾病患者的临床用药开辟了一条有效途径,在医药领域具有巨大发展前景。
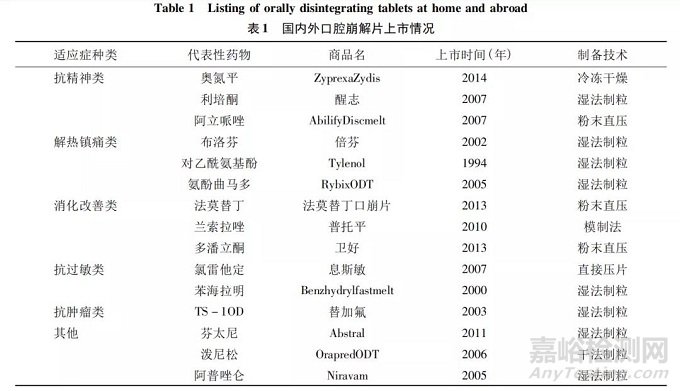
口腔崩解片( oral disintergrating tablets,ODTs) ,是指在口腔内无需水( 或仅需少量水) ,仅在唾液中即可实现快速崩解的新型固体速释制剂。药物可经口腔黏膜或食管黏膜吸收,也可借吞咽动力进入胃肠道起效。因此对于吞咽困难的老人、儿 童、昏迷患者、精神病患者等具有极高的顺应性。目前在美国、欧洲和日本等国家上市较多,国内生产的口崩片也多达 40 多种药物、150 多个品种,阿立哌唑口崩片、奥氮平口崩片等抗精神类药物也已批准上市。根据适应症类型,目前上市的口腔崩解片主要包括六大类,即解热镇痛类、抗精神类、消化改善类、抗过敏类、抗肿瘤类及其他。具体代表性药物及上市情况见表 1。口腔崩解片之所以能够快速成为研发热点之一,是因为它与普通片剂相比具有众多优势。
1 口腔崩解片的特点及优势
1. 1 服用方便、具有极高的顺应性
口腔崩解片在口腔中快速崩解,不存在吞咽困难,适用于老人、幼儿用药。并且,对于一些特殊病人如精神障碍患者,由于其经常不愿配合服药或在服药后偷偷吐掉,口腔崩解片可以很好的解决这一问题。不仅有益于病人恢复,也方便了医护人员的工作。同时,口腔崩解片也为野外饮水不便或突发极端情况下人们的医疗需求提供了保障。当前,研究者们依然在大力研发掩味矫味技术,努力改善口腔崩解片的口感,将进一步提升患者的顺应性。
1. 2 对食管及胃肠黏膜的刺激性小
普通片剂崩解缓慢,对胃肠道刺激性大的药物经常会引起患者的不适,甚至引发胃出血等。而口腔崩解片可在到达胃肠道之前吸收起效或是崩解成细小微粒,增大药物在胃肠道的分布吸收,进而极大降低了药物对食管和胃肠黏膜的刺激性。
1. 3 肝首过效应小、生物利用度高
口腔崩解片体积小,在口腔内即迅速崩解,可将药物设计成经口腔黏膜吸收,则可降低肝首过效应,提高生物利用度。
1. 4 局部靶向作用及延迟释药
口腔崩解片不仅可以速释,也可采用相应手段实现迟释,增加胃部滞留时间,增加局部药物浓度,从而提高疗效。例如采用阴离子交换树脂法进行掩味的口腔崩解片,其阳离子药物特殊部分( 如氨基酸集团) 在唾液条件下被树脂中的羧基官能团结合吸收,当接触到胃酸时重新释放出来,发挥药效[1]。Oldfield 等[2]对右旋兰索拉唑延迟释药口腔崩解片进行了临床药效分析,结果表明右旋兰索拉唑具有良好的耐受性和安全性。
2 口腔崩解片的质量要求
口腔崩解片应在口腔内迅速崩解或溶解、口感良好、容易吞咽、对口腔黏膜无刺激性,且应进行崩解时限检查( 难溶性药物应进行溶出度检查) 。常用检测崩解度的方法为传统的崩解篮法,该方法虽然可以测定 ODT 的崩解特性,但是不能对 ODT 的口感进行评价。日本的 Yoshida 等[3]研发的一种 OD-mate 崩解测定装置,不仅可以测定 ODT 的崩解特性,还可以 评 价 ODT 的 “苦味”程度,并通过与人味觉试验的味觉传感器测试结果高度相关,是一种良好的 ODT 性能评价仪器。其具体方法: 首先将口崩片置于一个梯形圆盘 上( 相 当 于 人 体 的“舌 头”) ,该 圆盘处于一个平底试管中。试验开始后,该圆盘会被两 个 合 适 重 量 压 缩 ( 相 当 于 人 体“上 颚”) ,模拟口腔环境。测试介质为 20 mL 纯化水( 37 ℃ ) ,试管一旦接触到水即视为实验开始,记录片剂完全崩解的时间。
3 口腔崩解片的制备技术
冷冻干燥技术所得片剂崩解性好,所以最先发展起来的制备口腔崩解片的技术就是冷冻干燥技术。例如著名的 Zydis 技术、Quicksolv 技 术、 Lyoc 技术、Nanocrystal 技术等。这些技术大多需要大型的冻干设备,工业化生产难度较高,大大提高了生产成本。这在一定程度上限制了冷冻干燥技术的发展。之后发展起来的制备口崩片的方法是工艺更为简单的湿法制粒[4]、粉末直压[5]和模制法[6]等。这些制备技术至今已发展的十分成熟,国内的大部分口腔崩解片都是采用粉末直压和湿法制粒制备。近年来,为了进一步制备出高质量和高性能的口崩片,研究者们基于这些传统技术,又发展了一些新技术,这些技术的研究重点主要是围绕影响口崩片的两个重要参数———崩解性能和机械强度。本文作者将对这些新的技术进行介绍。
3. 1 基于预混辅料的粉末直接压片法
粉末直接压片法是制备口腔崩解片的常用方法。不仅工艺简单,制得的口崩片崩解性能良好,且具有一定硬度。但是直接压片法对药物和辅料的性质有较高要求,传统单一辅料很难满足粉末直接压片工艺的要求,所以基于预混辅料的粉末直接压片近年来备受研究者青睐。Du 等[7 - 9]对口 崩 片 专 用 预 混 辅 料 Starlac,Pearlitol flash, Parteck odt,Prosolv odt 等进行粉体学性质研究,并分别应用于阿奇霉素、阿昔洛韦、天麻素、银杏叶提取物和山楂叶提取物五种活性药物成分,制得口腔崩解片。同时与其用对应物理混合物替代预混辅料同法制得的口崩片对照。经评估,采用预混辅料制得的口崩片具有口感良好、崩解性能强、溶出度高等特点。且四种预混辅料各有优势,可根据制备的具体需要来选择。如 Prosolv odt 制备的口崩片崩解迅速; Starlac 口感略甜、可压性好; Pearlitol flash 和 Parteck odt 口感清凉、无砂砾感,有效掩盖中药提取物的苦味。
3. 2 微波照射法
微波照射法[10]是用微波照射含有甘露醇、糖 醇、聚合物崩解剂和吸水剂的湿模塑片。甘露醇在微波照射下形成水蒸气,使片剂内部空隙膨胀,形成新的空隙网络。这些新的空隙网络使药片能够更有效地被水渗透,从而极大地缩短崩解时间。此外,微波照射时水蒸气的形成,也导致了表面部分甘露醇颗粒的溶解或沉淀,形成新的固体桥,这些新的固体桥显著提高了片剂的硬度,从而获得硬度适中且崩解良好的口崩片。Kishor 等[11]采用微波放射法辅助粉末直压制得的拉莫三嗪口腔崩解片,硬度完全可以满足包装要求,且崩解时间小于 60 s。但是 Syusuke 等[12]进一步研究发现,微波照射法仅适用于熔点高于 110 ℃ 的活性药物。对于熔点低于 110 ℃ 的药物如布洛芬( 熔 点 = 76 ℃ ) ,布洛芬颗粒在微波照射处理过程中熔融形成团聚体,从而阻止水分进入片芯,显著增加了布洛芬的崩解时间。但另外两种药物( 熔点均高于 110 ℃ ) 在微波处理过程中仍能很好的提升硬度,促进崩解,所以具体机制仍有待研究。Syusuke 等[12]预采用荧光探针来评估微波处理对不同活性成分口崩片的影响。
3. 3 喷雾干燥法
喷雾干燥法制备口崩片的关键是获得多孔性颗粒作为支撑骨架,然后加入药物、填充剂、矫味剂、崩解剂以及润滑剂等进行直接压片,最后得到的口崩片具有良好的崩解性能,水分可迅速进入片芯,在 30 s 内实现崩解。Hojun 等[13]为了增强多孔性,在普伐他汀中加入易升华物质碳酸氢胺,碳酸氢铵可在喷雾干燥过程中升华,无异味残留,也不添加杂质,且保证了多孔性。喷雾干燥法对药物和辅料的性质具有较高要求,可供选择的范围有限,且工艺较为复杂,放大生产仍有待改进。
3. 4 3D 打印技术
3D 打印技术是一种根据“逐层打印,层层叠加”原理,以计算机辅助设计为蓝本,由计算机控制制备具有特殊外形或复杂内部结构物体的快速成型技术[14]。
3D 打印制备的 ODT 是由粉末堆积固化成型,未经压缩过程,所以片剂孔隙率高、内表面积大、崩解速度快。3D 打印技术能够通过计算机的程序控制,实现精准的制备过程,从而获得具有较好崩解性和机械性的片子,载药量准确度高,能实现个性化给药[15]。Tian 等[16]采用 3D 打印技术制备的个体化剂量的华法林钠口崩片,性能稳定,质量合格,所以 3D 打印为新型口服速溶给药系统的研究和个性化剂量给药提供了新的策略。
2015 年获得 FDA 批准上市的左乙拉西坦速溶片就是采用 3D 打印技术制备的[17 - 19]。该片剂内部多孔,能在 10 s 内迅速崩解,其体内临床试验表明,该片可在 9 min 即达到最大血药浓度,为快速治疗癫痫症提供了临床保证。
3D 打印技术操作简单、速度快、工艺重复性好,易工业化放大,但其对药物及辅料性能有较高要求。
3. 5 溶媒吸附法
Cheol-hee 等[20] 采用溶媒吸附法,研制了包含盐酸他松香缓释微粒的口腔崩解片。具体过程是采用高速捏合造粒机使物料均一分布,加入脂质( 蜂蜡和没食子酸甘油酯) 和乙基纤维素混悬液以延缓药物释放,金属铝酸镁作为吸附剂。该法制备的口崩片具有较好的硬度和快速崩解性,且简单高效,证明了溶媒吸附法制备缓控释微粒的可行性。
4 口腔崩解片的掩味技术
药物大多具有“苦味”,口腔崩解片作为口服用药,口感体验更是十分重要。研究者在不断增强口崩片性能的同时,也应用了一系列掩味技术,来改善口崩片的口感,更加提高用药者的顺应性。
4. 1 矫味技术
加入矫味剂来掩盖药物“苦味”是最常用的掩味技术。常见的矫味剂包括: 1) 甜味剂,如蔗糖、葡萄糖、麦芽糖醇等通过赋予甜味来掩盖苦味; 2) 苦味阻滞剂,环糊精是最常用的络合剂,也是一类重要的苦味阻滞剂。环糊精通过形成非共价包合物,降低药物与味蕾的接触,从而起到掩味作用。Wan 等[21]制备了冬凌草甲素环糊精包合物口腔崩解片,将药物分子嵌入羟丙基-β-CD 的内腔中形成超微粒分散物,很好地掩盖了冬陵草甲素的苦味。
4. 2 物理屏蔽技术
物理屏蔽技术是指在药物与味觉细胞感受器之间建立物理屏障,阻断药物与味觉受体结合。常用的物理屏蔽技术有粉末或微粒包衣技术、微囊技术、固体分散体等。
4. 2. 1 微粒包衣掩味技术
流化床微粒包衣不仅可以实现掩味,还可以实现 OD 片的缓控释和提高稳定性,包衣速度快、且不易结块。Ju-young 等[22]比较研究了喷雾干燥和流化床微粒包衣制备的普拉米克索控释ODT 微颗粒,流化床微粒包衣所制备的 ODT 释放行为良好,不易突释。Shin-ichro 等[23]利用可视模拟比例尺评价了不同粒径、涂层、材料类型的核心颗粒的口腔崩解片的适口性,发现当 ODT 的粒径较大时,感觉到粗糙度和口感不适。
4. 2. 2 微囊掩味技术
微囊技术常采用共凝聚或相分离工艺,使用具有各种孔隙率特征的不同聚合物膜材。一种共凝聚工艺是以乙基纤维素为囊材聚合物,在晶体或颗粒上均匀包覆具有所需厚度和孔隙率的聚合物衣膜,在苦味活性药用成份与味蕾之间形成物理屏障。Zhang 等[24]采用该技术制备了盐酸小檗碱微囊口腔崩解片有效掩盖了苦味,且在体内可快速崩解起效。
4. 2. 3 固体分散掩味技术
药物微粒与载体形成的固体分散体可改变药物溶出与释放特性、药物稳定性、气味和刺激性等。例如发展逐渐成熟的热熔挤出技术就是利用这一原理。热熔挤出的过程是在高温条件下用旋转螺杆将熔融分散的原辅料,经模具压出,形成挤出物。具有无溶剂、工艺步骤少、可连续操作、易规模化生产等优势。其原理主要是在高温和搅拌下,产生药物与基质的相互作用,包括药物分子在聚合物中的溶解、药物与聚合物电荷作用等,药物被嵌入聚合物基质中,减少了药物口腔暴露量,达到药物苦味掩盖目的。该技术已成功用于对乙酰氨基酚缓释掩味颗粒、硝苯地平、依曲康唑、尼莫地平、吲哚美辛和布洛芬等口崩片的制备[25]。
4. 3 物理化学掩味修
饰制备前体药物降低药物溶解性、离子交换、络合等化学或物理修饰的技术也用于药物掩味。其 中,药物 - 树脂吸附技术发展迅速。具体机制为:药物通过弱离子键合形成吸附物或树脂盐,在唾液 pH 条件下,药物 - 树脂络合物能够稳定存在,从而在口腔中达到掩味的目的。接下来药物 - 树脂络合物到达胃肠道,在胃肠道降解释放药物,树脂脱落排除体外,树脂的理化特性和胃肠道的钠、 钾、氯等离子环境可改变药物的释放性能。Ge 等[1]用离子交换树脂法对盐酸苯环壬酯片进行掩味,结果良好。
5 口腔崩解片存在的主要问题
5. 1 载药量问题
口腔崩解片无需用水送服即快速崩解,故制备时需添加大量有助于崩解的辅料,导致主药剂量不能过大。因此,单剂量过大的药物不适于制成口崩片。但当今药物的发展趋势都趋向于低剂量、高药效,或许剂量问题不再是影响口崩片的重要因素。
5. 2 药物硬度和易碎性
直接压片法制备的口崩片硬度与崩解时间有很大联系。一定压力范围下,压力越大,硬度越大,崩解时间越长,达不到口崩片的崩解要求; 若压力过小,片剂不能成型。因此制备口崩片时应注意压力与辅料配比,在一定硬度范围下,保证高孔隙性,即崩解时间达标。冻干法制备的口崩片硬度较小、脆性极大,极易破碎,使其包装复杂、成本提高。应开发有效提高冻干法硬度方法,又不降低崩解性,从而提高包装的简便性。
5. 3 口腔崩解片的口感
由于矫味剂和掩味技术的快速发展,口崩片的不良气味及原料药苦味等问题已得到较大的改善,但由于辅料用量较大,口崩片在口腔崩解后依然存在砂砾感,该问题尚需要进一步改善和解决。可以从减小粒径、开发新型辅料或从食品工艺中寻找思路等方面加以解决。
6 前景展望
口腔崩解片服用方便,便于携带,可实现个性化给药,对于速效和控释均有优势,发展空间巨大。随着工艺技术的不断发展成熟,性能更加优越的口腔崩解片将拥有更大的市场和经济效益。

来源:沈阳药科大学学报


