您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-10-09 21:30
医疗器械行业与药品行业都是致力于人类健康的,两个行业一直以来就存在相互融合与重叠的地方。科学技术的进步也不断促使两个行业的结合,特别是软件以及嵌入技术的应用模糊了两个行业的界限。新技术的发展在增加产品复杂性的同时,也带来了法规监管的复杂性。
欧盟委员会及监管机构,如EMA,通过制定药物与器械组合产品的指南文件来协调法规要求,以推动新的组合产品的上市。新的医疗器械法规MDR【1】和体外诊断医疗器械法规IVDR【2】对不同情况的组合产品的法规要求也进行了规定。
本文将讨论不同药物与器械组合产品在欧盟法规框架下的合规路径。
# 备注#
欧盟法规中没有药物与器械组合产品的明确定义,本白皮书中的药械组合产品指的是医疗器械组合了药物(包括生物制品)的治疗/诊断产品。
本文主要内容源自BSI医疗器械白皮书《药品行业与器械行业的融合》中关于法规监管方面的内容,但没有包含白皮书中关于药物与器械组合产品的详细举例介绍以及相关技术发展情况的介绍内容。
考虑到中国最近发布了新的药械组合产品的注册要求,本文在最后以附论的形式对欧盟与中国此类产品的评审注册进行简要的比较。
本文概览
1.欧盟药物与器械组合产品的4种不同情况及相对应的合规路径概述
2.药械组合产品(药物起主要作用)的法规总结
3.械药组合产品(器械起主要作用)的法规总结
4.药物输注类器械的法规总结
5.上市后考量
6.结论
7.附论——欧盟与中国对药械组合产品评审上的比较
1、Introduction
欧盟药械组合产品的4种不同情况及相对应的合规路径概述
在欧盟,药物与器械组合产品有可能作为药品,也有可能作为器械进行监管,具体取决于产品主要的作用原理。如下是欧盟药物与器械组合产品4种不同情况下合规路径的对应表:
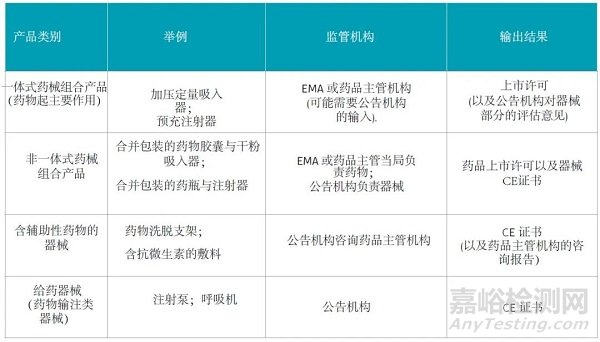
MDR Article 1(8)规定了对一体式含药器械的法规要求:
当药物起辅助作用时,产品作为医疗器械进行监管。当药物作用被认为是辅助作用时,公告机构需要在颁发此类产品的CE证书前获得药品主管机构的科学意见。
当药物起主要作用时,组合产品按药品法规进行监管。这种情况下,MDR的通用安全与性能的要求(GSPR)需要适用器械部分。
MDR Article 1(9)规定了对给药器械的法规要求:
a)如果给药器械与药品组合为一体上市,这种组合下的器械部分是专用于其组合的药品的使用,且不能被重复使用。这种组合产品按照药品法规进行监管,这种情况下,MDR的通用安全与性能的要求(GSPR)需要尽可能的适用器械部分;
b)其它情况下,给药器械按照医疗器械法规进行监管。当医疗器械没有和药品进行物理上的组合,那么器械需要符合医疗器械的法规要求,加贴CE标识,药品必须按照药品指令获得使用上市许可。
根据MDR Article 117规定了药品指令【3】的修订要求,当一体式药械组合产品(药物其主要作用)制造商向欧盟药品评审机构递交产品注册资料时,需要包含器械部分满足MDR GSPR的评审结论。
为了实施相应的要求,欧盟药品管理局EMA在其网站发布了关于医疗器械专题网页:
https://www.ema.europa.eu/en/human-regulatory/overview/medical-devices
其中包含了如下值得关注的EMA发布的文件:
(1)关于EMA配合实施MDR与IVDR实施的Q&A文件
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/questions-answers-implementation-medical-devices-vitro-diagnostic-medical-devices-regulations-eu/745-eu-2017/746_en.pdf
(2)与器械一起使用情况下的药品质量文件指南
https://www.ema.europa.eu/en/quality-documentation-medicinal-products-when-used-medical-device
(3)咨询程序-含辅助药物成份的医疗器械
https://www.ema.europa.eu/en/human-regulatory/overview/medical-devices/consultation-procedure-ancillary-medicinal-substances-medical-devices
2、Summary
药械组合产品(药物起主要作用)的法规总结
药械组合产品(药物起主要作用)的典型例子包括:预充注射器,加压定量吸入器(pMDI), 自助注射器,无针胰岛素注射器等。
注:英文白皮书中对药械组合产品有较详细的举例和说明,详见英文白皮书
如上文所讲,一次性且一体专用的药械组合产品(DDCs)是按照药品指令进行监管的。MDR Article 117提出对药品指令(2001/83/EC)附录I 3.2章节第12点的修订:
根据MDR Article 1(8)或MDR Article 1(9)第二小段,归属药品指令监管的药械组合产品,其上市许可申请文档,应包括根据MDR附录I GSPR的要求对器械部分进行符合性评估的评估结果,可行时,评估结果应包含在使制造商可以在器械上加贴CE标识的制造商EU符合性声明或公告机构颁发的相关证书中。
欧盟药品管理局(EMA)与各成员国主管机构要求制造商递交的上市许可申请资料中包括器械的CE证书或符合性声明(I类不需要公告机构介入时),特定情况下(没有公告机构颁发的CE证书,当假设器械部分可以单独使用,又属于需要公告机构介入的情况),需要有公告机构对器械的符合性评估意见。MDR下,公告机构可以提供一份报告给制造商,详细的包含关于器械符合性的评估意见。获得MDR授权的公告机构清单在欧盟的NANDO数据库中可以查询。
3、Summary
械药组合产品(器械起主要作用)的法规总结
械药组合产品(器械起主要作用)的典型例子包括:药物洗脱支架,含抗菌剂的敷料等
注:英文白皮书中对药械组合产品有较详细的举例和说明,详见英文白皮书
MDR 附录 VIII规则 14
所有含有某种物质的器械,当这种物质根据第 2001/83/EC 号指令第 1 条第 2 点的规定,在单独使用时,可被视为一种药品时(也包括该指令第 1 条第 10 点所定义的源自人体血液或血浆的药品),且该物质在该器械起辅助性作用,此类器械均归类为 III 类。
因此在欧盟,械/药组合产品(器械起主要作用)是作为医疗器械进行监管的,上市前需要符合MDR的要求,根据MDR 附录IX Article 5.2(b)的要求,对辅助药物按照药品指令进行模拟评审,不管辅助药物是否易作用于人体。因此除了满足MDR的要求,还需要有描述药物信息、在器械中如何被组合/放入、在器械中进行怎样的测试,以及临床与非临床安全信息的药品技术文档。为了符合药物指令,文档应符合通用技术文档的格式。同时还需要提供给公告机构一份描述器械中增加这种药物的风险/受益的分析报告。只有当辅助性药物的风险/受益评价结果是正面结论(受益大于风险)时才能获得MDR证书。MDR中的药品咨询过程需要按照2001/83/EC药物指令的药物评审过程进行,咨询过程的期限要求为210天。
辅助性药物的任何变化,比如:生产、测试、与器械的结合方式的变化,以及任何会影响械药组合产品稳定性或适应症上的变化,都需要向最初咨询的药品主管机构进行补充咨询。这些变化都要按照变更程序进行,对变更的补充咨询的期限是60天。
药物咨询程序需要的药品技术文档提交要求参见:
EMA技术文档要求:
https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/ema-recommendation-procedural-aspects-dossier-requirements-consultation-ema-notified-body-ancillary_en.pdf
人用药品申请者通知:
https://ec.europa.eu/health/sites/default/files/files/eudralex/vol-2/b/update_200805/ctd_05-2008_en.pdf
MEDDEV 2.1/3 rev 3:
http://www.meddev.info/_documents/2_1_3_rev_3-12_2009_en.pdf
4、Summary
药物输注类器械的法规总结
药品输注类器械(非一体/非专用)需要按照MDR进行合规评估;当属于有源器械(有使用储存的能量)时,其分类适用Annex VIII rule 12。此类器械的预期用途需要结合药品才能实现,由于器械与药物是分开的,在器械的认证过程中,预期用途的考量是非常重要的,以确保其IFU和宣传材料中所提到的所有适用的药品都是有使用许可的。器械不能用于未经批准的药物的使用。
GSPR 10.3规定:如果器械的预期用途是给药,这些器械应按照相关药品的管理规定以及符合药品适应证和器械预期用途的性能保持要求,以与相关药品相兼容的方式进行设计和制造。
当器械制造商改变药物输注方式时,需要注意其预期输注药物的监管状态。如果器械影响药物的药物代谢动力学性能,许可使用传统输注方式的药品不是必然的许可使用新的输注器械。进一步信息见GSPR 10.3。
5、Post-Market
上市后考量
药物与器械组合产品的制造商都需要面临来自EMA关于主动的上市后监督的要求。当递交上市许可申请时,需要认真考虑如何符合上市后安全报告方面的要求,因为仅仅依赖被动的投诉和不良事件报告的上市后监督方式是不能被接受的,制造商需要准备上市后监督计划。MDR附录XIV也强化了上市后风险评估的法规要求。医疗器械法规中的上市后监督要求同样适用于按照药品指令进行监管的药械组合产品。
根据MDR,上市后监督计划必须包含主动收集,记录和调查来自医护专业人员,病人以及使用者的与器械相关的投诉以及不良事件信息的要求,以确认器械全生命周期的安全与有效性,保证已识别风险以及基于事实证据的新识别的风险的持续可接受性。这就需要有体系来保证及早发现器械可能的故障、并发症以及使用数年甚至数十年后才可能发生的这两方面的情况,并保证适宜的风险降低措施的实施。这意味着产品开发人员需要从多角度来考虑产品全生命周期的风险,比如:材料、人因工程等。
对介于器械与药物的产品而言,上市后监督同样重要。所有报告的分析都需要各部门的通力合作来确保合适的专家参与以及合适的数据输入。2018年Kastanos K提出一个关于使用含紫杉醇用于治疗股腘动脉闭塞性疾病的器械的潜在长期安全关注【4】。此关注就是通过Meta分析提出的,分析提示含紫杉醇的球囊和支架相比不含药的此类产品存在潜在安全方面的关切,此关切的提出需要跨部门团队来理解这些数据对器械的影响,这些效应是否与药物成份、使用的支架、特定的病患群体有关,抑或与这些器械使用的临床实践过程有关,这些都需要药物与器械专家从产品的开发到制造,一直到上市后数据的分析通过互动交流的方式才能确认。
备注:Meta分析:对具备特定条件的、同课题的诸多研究结果进行综合的一类统计方法
6、Conclusion
结论
随着科技的发展,药品与器械的交叉融合越加突出。对于制造商以及立法者而言,法规监管变得更具挑战性,最新的法规有助于管理这种交叉状况,也可能有助于应对state-of-the-art的变化。新技术给行业及其监管方也带来新的监管领域和挑战。监管方与行业正在一起努力找到一条既能避免阻碍创新,又能保证公众安全的监管道路。随着法规的协调,新技术的进步以及药物与器械交叉领域的繁荣发展,可以预见病人健康保证水平可以因此获得提高。
7、Comparison
欧盟与中国对药械组合产品评审上的比较
中国国家药监局于2021.7.23发布了新的《关于药械组合产品注册有关事宜的通告》(2021年第52号)【5】,对药品与医疗器械共同组成,并作为一个单一实体生产的医疗产品的注册事宜进行了规定。如下是欧盟与中国在相关事宜上的简单比较:
1. 通告中规定了药械组合产品管理属性判定准则:药物起主要作用归属药品法规管理,器械起主要作用归属器械法规管理;这与欧盟的判定准则相一致。
2. 通告中规定了当管理属性难以判定时的界定程序:对于药械组合产品不能确定管理属性的,申请人应当在申报注册前向国家药品监督管理局医疗器械标准管理中心申请药械组合产品属性界定。相比较而言,欧盟的界定过程比较复杂,根据欧盟医疗器械法规MDR前言部分第8点:在遇到法规适用问题时,成员国主管机构有责任逐例确定具体产品的法规适用性,当成员国找不出明确依据/给不出确定结论时,欧盟委员会应进行裁定,裁定时应适当向欧盟其它监管机构,如应欧盟药品管理局、欧盟化学品管理局和欧洲食品安全局,进行咨询。
欧盟临界产品界定机构列表:
https://ec.europa.eu/health/sites/default/files/md_topics-interest/docs/md_mdeg-borderline-classification_en.pdf
尽管欧盟的法规适用界定比较复杂,不过难以界定的情况很少,另外,欧盟有发布临界产品手册,对其收到的临界产品的法规适用进行逐例说明。其中已经列出了23个与药品法规相界定的案例。
临界产品判定手册:
https://ec.europa.eu/health/sites/default/files/md_topics-interest/docs/md_borderline_manual_05_2019_en.pdf
3. 通告中规定了药品审评中心与医疗器械技术审评中心建立协调机制的要求,需要根据实际情况确定是否需要联合评审,而欧盟则明确规定了公告机构提供评估意见(对药物起主要作用的药械组合产品),以及公告机构咨询药品主管机构的要求(对器械起主要作用的械药组合产品)。

来源:bsiHealthcare


