您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-11 10:04
BCS分类介绍
人体生物等效性研究(Bioequivalence,BE)是证明制剂之间治疗等效性的一种手段。
1995年,Amidon 等人[1]提出生物药剂学分类系统( Biopharmaceutics Classification System,BCS) 将药物按照溶解度和渗透性进行分类,并以此来预测药物在体内的吸收。
在此之前很难有一个科学的理论可以作为依据向监管机构提出生物等效性豁免。随着BCS概念的提出和不断得到论证,越来越多的监管机构开始并接受基于BCS的生物等效性豁免。
2000年8月,FDA 发布了将BCS应用于速释固体口服制剂的生物等效性豁免的指导原则。WHO则于2006年发布的Technical Report Series No.937,其中 Annex7和Annex8引入了基于BCS的生物等效性豁免,EMA于2010年发布的生物等效性研究指南。我国也于2016年5月发布了《人体生物等效性试验 豁免指导原则》(2016年第87号通告 )[2]。
BCS系统是按照药物的水溶性和肠道渗透性对其进行分类的一个科学架构。当涉及到口服固体常释制剂中活性药物成分(Active Pharmaceutical Ingredient,以下简称API)在体内吸收速度和程度时,BCS系统主要考虑以下三个关键因素,即:药物溶解性(Solubility)、肠道渗透性(Intestinal permeability)和制剂溶出度(Dissolution)。
药物溶解性(Solubility)
药物制剂的溶解性是以药物的最高剂量测定的,在pH 1~7.5范围,药物的最高剂量可溶解在不超过250ml水中,定义为高溶解性的药物,否则被定义为低溶解性的药物。
肠道渗透性(Intestinal permeability)
药物的膜通透性是口服药物制剂与静脉注射参照剂量或肠灌注平衡剂量研究结果进行对比,如果药物在肠道的吸收程度不少于90%,药物被定义为高膜通透性。
制剂溶出度(Dissolution)
制剂的溶出是影响药物体内吸收的一项关键因素,一般情况下,BCSⅡ类和BCSⅣ类药物溶解性较差,因此在制剂过程中,通常考虑采用一些特殊的制剂方法来提高药物在体内的溶解性。
根据BCS分类系统,药品被分为以下四类:
第Ⅰ类:高溶解性、高渗透性(High Solubility- High Permeability)
第Ⅱ类:低溶解性、高渗透性(Low Solubility-High Permeability)
第Ⅲ类:高溶解性、低渗透性(High Solubility-Low Permeability)
第Ⅳ类:低溶解性、低渗透性(Low Solubility-Low Permeability)
基于 BCS 的生物等效性豁免
制剂之间的治疗等效性一般需要进行体内生物等效性研究来论证,但是如果体外研究能够充分证明体内性能无差异,那么可以豁免此项研究。对于特定剂型,在符合某一标准时, BCS 可以作为申请人和监管机构评判是否可以豁免生物等效性研究的工具。
生物等效豁免申请的其他影响因素,当一个口服固体常释制剂申请基于BCS分类的生物等效性豁免时,应注意以下因素可能影响生物等效豁免:
01辅料
BCS1类药物:辅料有时候可能会影响药物的吸收速率和吸收程度。一般来说使用已经批准的常释制剂常用辅料,对于BCS1类快速溶出的常释制剂的药物吸收速率和吸收程度不会有影响。
BCS3类药物:该类药物和BCS1类药物不同,如果想要申请生物等效豁免,必须有更充分的科学依据。
02前药
前药的渗透性通常取决于转化药物的机理和(解剖学上的)部位。若药物前体-药物的转化主要表现在肠道膜渗透之后,则应测定该药物前体的渗透性。若转化表现在肠道膜渗透之前,则应测定该药物的渗透性。
03复方制剂
当口服固体常释的复方制剂中各活性组分均为BCS1类药物,可按BCS1类药物要求申请生物豁免,但应证明各组分之间以及各组分与所有辅料之间没有药物代谢动力学相互作用,否则不能申请豁免。
04基于BCS 的生物豁免对下列情况不适用
(1)治疗范围狭窄的药品
受治疗药物浓度或药效监控的制约,按狭窄的治疗范围设计的制剂,不适用生物等效性豁免。如:地高辛、锂制剂、苯妥英、茶碱和华法林阻凝剂。
(2)口腔吸收制剂
由于BCS分类是基于胃肠粘膜的渗透和吸收,因此不适用于口腔吸收制剂,如:类似舌下片或颊下片的制剂。对于口含片、口腔崩解片等,如果该制剂从口腔吸收也不适用。
FDA、WHO、EMA、NMPA关于BCS分类原则异同对比
表1 原料药高溶解性的定义及测定方法
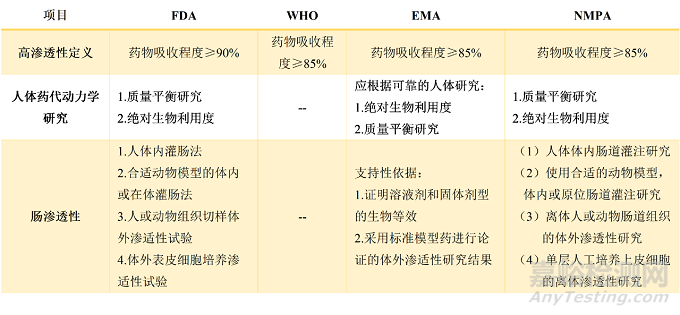
表2 原料药高渗透性的定义及测定方法
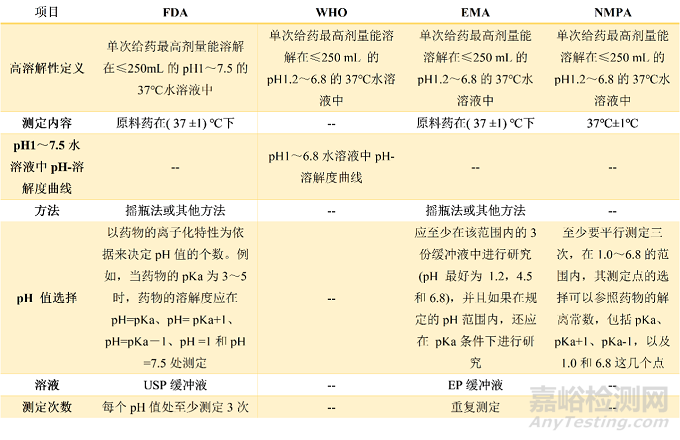
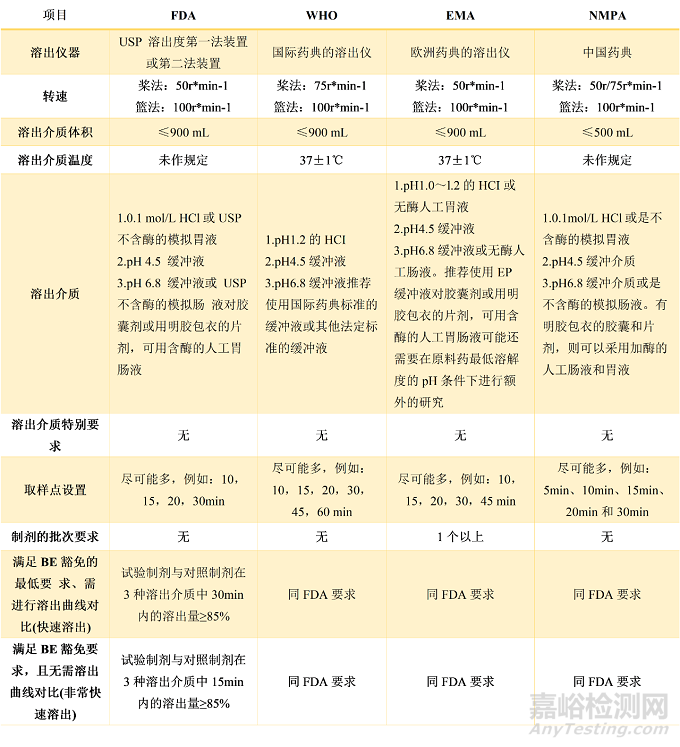
表3 制剂溶出度测定方法
参考文献:
[1] Amidon GL, Lennernäs H, Shah VP, et al. A Theoretical Basis for a Biopharmaceutic Drug Classification: The Correlation of in Vitro Drug Product Dissolution and in Vivo Bioavailability [J]. Pharm Res. 1995, 12 (3): 413-420.
[2] 国家食品药品监督管理总局. 总局关于发布人体生物等效性试验豁免指导原则的通告(2016年第87号)
[3] FDA指导原则
[4] WHO指导原则
[5] EMA指导原则
[6] NMPA指导原则

来源:药渡


