您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-25 11:52
摘要 目的:建立加校正因子的主成分自身对照法测定马来酸依那普利片有关物质的含量。方法:用辛烷基硅烷键合硅胶为填充剂,以磷酸盐缓冲溶液(0.01mol·L-1磷酸二氢钾溶液,用磷酸调 pH值为2.2)-乙腈(75:25)为流动相;检测波长215nm;柱温为50℃。测定依那普利拉(杂质Ⅰ)和依那普利双酮(杂质Ⅱ)相对于依那普利的校正因子,并进行定量分析。结果:各色谱系统中依那普利与相邻杂质及各已知杂质间分离良好,依那普利和杂质Ⅰ、杂质Ⅱ在0.5~30μg·mL-1浓度范围内线性关系良好 (r> 0. 999);杂质Ⅰ、杂质Ⅱ校正因子分别为0.71、0.92;杂质Ⅰ的定量方式以加校正因子的主成分自身对照法为宜,加校正因子的主成分自身对照法和外标法测得结果无显著性差异。结论:该方法简便快速,可准确测定马来酸依那普利片的有关物质。
关键词:马来酸依那普利片;有关物质;校正因子; 高效液相色谱法
中图分类号:R921.2 文献标识码:A 文章编号:1009-3656(2021)
doi:10.19778/j.chp.2021.00.
Determination of related substances in enalapril maleate tablets with main component self-control method with calibration factor
WEI Kai1,LI Xin2
1. Heilongjiang Timehome Pharmaceutical Co., Ltd., Harbin 150025, China;
2. Harbin Institute for Food and Drug Control, Harbin 150001, China
Abstract Objective: To establish the method of main component self-control with calibration factor to determine the related substances in enalapril maleate tablets. Methods: The test was performed on octyl silane bonded silica gel column with the elution of phosphate buffer solution (pH adjusted to 2.2 with phosphoric acid)-acetonitrile (75:25). The column temperature was 50℃, and the detection wavelength was 215 nm. The calibration factors of enalaprilat (impurity I) and enalapril diketopiperazine (impurity II) related to enalapril were determined, then the quantitative analysis of the impurities was carried out. Results:The resolutions between enalapril and the adjacent peaks as well as the known impurities all met the requirements. The calibration curves of enalapril and impurities I and II were linear in the range of 0. 5-30 μg·mL-1 ( r > 0. 999) . The calibration factors of impurities I and II were 0.71 and 0.92, respectively. The main component self-control method with calibration factor could be used for the quantitative analysis of impurity I. There was no significant difference between the results determined by the external standard method and the main component self-control method with calibration factor. Conclusion:The established method was simple and accurate, and it was suitable for the determination of related substances in enalapril maleate tablets.
Key words:enalapril maleate tablets;related substances; relative calibration factor; HPLC;
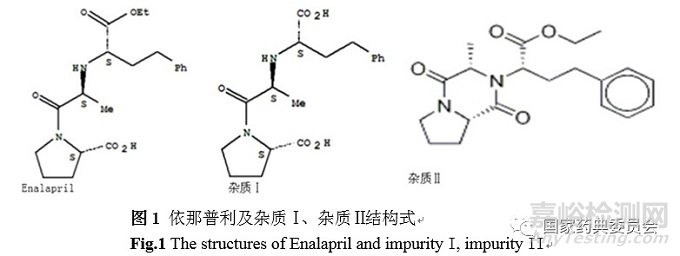
依那普利片(Enalapril ) 是临床上常用于抗高血压的血管紧张素酶抑制剂。依那普利一般以马来酸盐的形式存在,常用剂型为片剂。依那普利的主要降解产物为依那普利拉(enalaprilat)和依那普利二酮哌嗪(enalaprildiketopiperazine)[1]。
依那普利片已收载入BP2018[2],主成分为马来酸依那普利,检测杂质有三个,分别为依那普利拉、依那普利双酮和其他杂质,采用主成分自身对照法计算总杂质的量,其中依那普利拉的校正因子为0.7,依那普利双酮无校正因子。马来酸依那普利片已收载入《中华人民共和国药典》(以下简称《中国药典》)2015年版[3]和日本药局方 XVII[4]。《中国药典》2015年版和日本药局方 XVII均收载2个已知杂质, 分别为依那普利拉和依那普利双酮,采用主成分自身对照法计算总杂质的量,均无校正因子。随着对杂质研究的逐渐深入, 科研人员越来越倾向于对已知杂质采用外标法或加校正因子的主成分自身对照法定量。
1、仪器与试药
1.1仪器
Agilent1200型高效液相色谱仪,Waters2695-2998型高效液相色谱仪,Thermo U3000型高效液相色谱仪,Mettler XS 105 DU分析天平电子天平,色谱柱Agilent Eclipse Plus C8(4.6mm×150mm,5μm),CAPCELLPAK C8(4.6mm×150mm,5μm),TechMateC8-ST Ⅱ(4.6mm×250mm,5μm)。.
1.2试药
马来酸依那普利对照品(100705-201604,含量99.9%),马来酸(190015-201302,含量99.7%) ,依那普利拉(100707-201803,含量88.1%)均购自中国食品药品检定研究院,依那普利双酮 (TORONTO RESEARCH CHEMICALS INC,6-BSR-145-1,98%),马来酸依那普利片 (企业A,批号014171101,014180301,规格10mg;企业B,批号18032013,规格5mg),乙腈为色谱纯, 其他试剂均为分析纯, 水为超纯水。
2、分析方法与结果
2.1色谱条件
流动相:磷酸盐缓冲溶液(0.01mol· L-1磷酸二氢钾溶液,用磷酸调 pH 值为2.2)-乙腈(75:25),色谱柱为AgilentEclipse Plus C8(4.6mm×150mm,5μm),检测波长为215nm,进样量为20μL,流速为2.0mL· min-1,柱温为50℃,采集时间为30min。
2.2溶液的制备
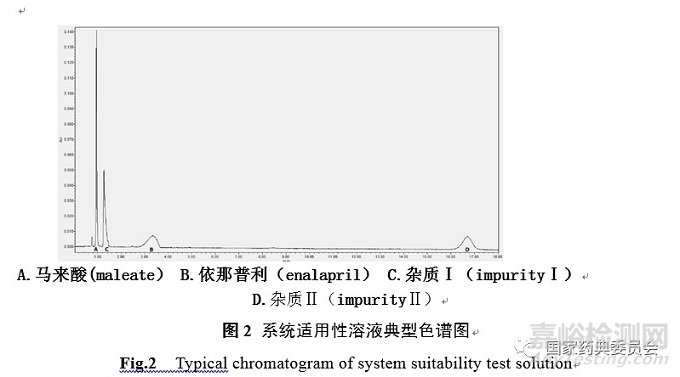
2.2.1系统适用性溶液 取马来酸依那普利及杂质Ⅰ、杂质Ⅱ对照品各10mg,精密称定,分别置100mL量瓶中,加流动相溶解并稀释至刻度,摇匀作为对照品储备液。精密量取上述三种对照品储备液各2mL, 置同一10mL量瓶中,加流动相稀释至刻度,摇匀,作为系统适用性试验溶液。
依那普利峰拖尾因子应小于2.0,马来酸峰与依那普利拉峰的分离度应符合要求,依那普利拉与依那普利、依那普利双酮各峰之间的分离度均应不低于4.0。
2.2.2对照品溶液 精密量取马来酸依那普利及杂质Ⅰ、杂质Ⅱ对照品储备溶液各2mL,置同一100mL量瓶中,加流动相溶解并稀释至刻度。
2.2.3供试品溶液 精密称取本品细粉适量(相当于马来酸依那普利10mg),置5mL量瓶中,加流动相超声溶解并稀释至刻度。
2.2.4 对照溶液 精密量取供试品溶液3mL置100mL量瓶中,加流动相稀释至刻度,摇匀,即得。2.3线性关系、相对保留时间及校正因子的测定
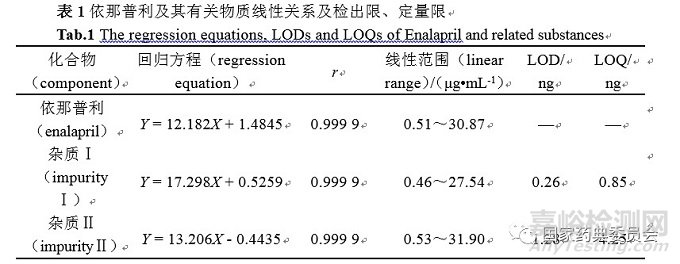
依次精密量取马来酸依那普利及杂质Ⅰ、杂质Ⅱ对照品储备溶液各0.5、1.0、2.0、5.0mL,置同一100mL量瓶中,加流动相稀释至刻度,摇匀,另依次精密量取三种对照品储备溶液各1.0、2.0、3.0mL,置同一10mL量瓶中,加流动相稀释至刻度,摇匀,得到系列标准曲线溶液。精密量取系列标准曲线溶液各20μL,按“2.1”项下色谱条件,进样,记录色谱图,以峰面积积分值为纵坐标(Y),各对照品溶液的浓度为横坐标(X),进行线性回归,其线性方程见表1。
2.4定量限与检测限
将混合对照品溶液加流动相逐级稀释,按“2.1”项下色谱条件测定,以S/N=10求得各组分的定量限,以S/N=3求得各组分的检测限,结果见表1。
2.5 回收率试验
取9份已知2种杂质含量的同一批号(批号:014171101)的供试品细粉适量,精密称定,分别精密加入相当于2种杂质含量的80%、100%与120%的杂质对照品,按“2.2.3”项下方法制备高、中、低3种浓度的溶液,进样测定。杂质Ⅰ的平均回收率为99.71%(RSD1.8%),杂质Ⅱ的平均回收率为99.71%(RSD1.7%)。
2.6 重复性试验
取样品(批号:014171101),按“2.2.3”项下供试品溶液制备方法,平行制备6份供试品溶液,按“2.1”项下色谱条件进样,记录色谱图,经标准曲线法计算2种杂质含量,杂质Ⅰ、Ⅱ的含量的RSD分别为0.76%、1.39%,表明方法重复性良好。
2.7 精密度试验
取混合对照品溶液,按“2.1”项下色谱条件连续进样6次,计算混合对照品溶液中各色谱峰面积,其RSD分别为0.42%、0.72%,表明方法精密度良好。
2.8稳定性试验
取样品溶液(批号:014171101),按“2.2.3”项下方法制备供试品溶液,分别在0、2、4、8、12h进样测定,测定杂质Ⅰ、Ⅱ峰面积RSD分别为0.22%、1.50%,表明供试品溶液室温下放置12h内稳定性良好。
2.9专属性试验
精密称取样品(批号:014171101)适量,共5份(每份相当于马来酸依那普利10mg),分别置于5mL量瓶中,经1mol·L-1的盐酸溶液、1 mol·L-1的氢氧化钠溶液、30%过氧化氢溶液、95℃水浴加热、4000lx光照处理破坏后进样测定。结果依那普利与杂质Ⅰ、Ⅱ峰之间互不干扰,且其他降解产物峰与3种成分色谱峰的分离度均符合要求。典型色谱图见图3。
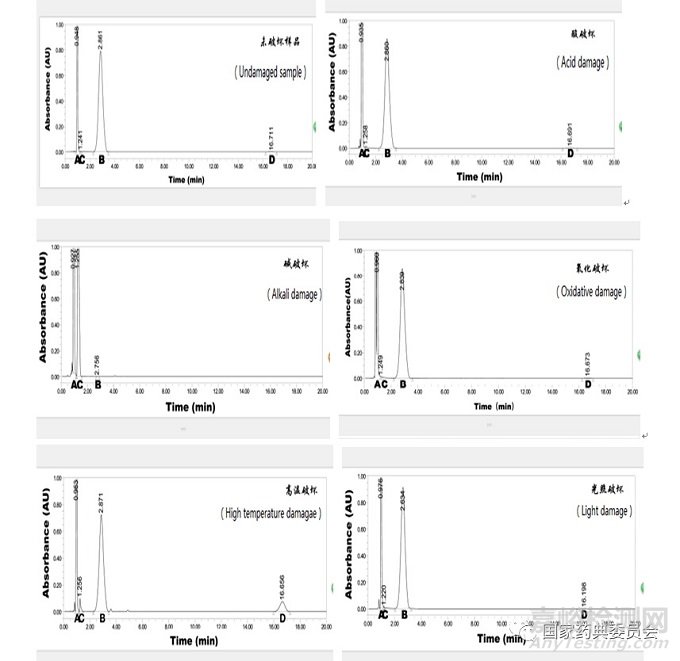
A.马来酸(maleate) B.依那普利(enalapril) C.杂质Ⅰ(impurityⅠ)
D.杂质Ⅱ(impurityⅡ)
图3专属性试验典型色谱图
Fig.3 The typicalchromatograms of specificity test
2.10杂质相对保留时间与相对校正因子的计算
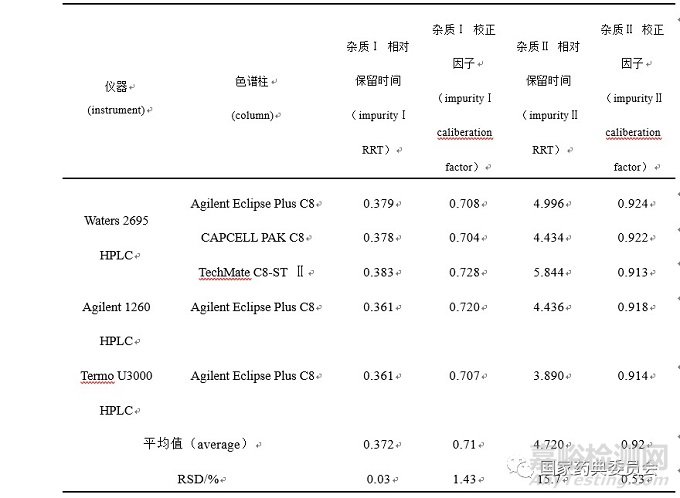
根据相关参考文献中校正因子的计算方法[5-7],本研究确定了各杂质相对于依那普利的校正因子计算方法。以标准曲线各浓度点色谱峰的平均保留时间(tR)计算依那普利各杂质相对于依那普利的相对保留时间(RRT),RRT=tR杂质/tR依那普利.。以依那普利和杂质Ⅰ、杂质Ⅱ的线性方程斜率计算依那普利各杂质相对于依那普利的校正因子(f),f=k依那普利/k杂质,其中k依那普利为依那普利的线性方程斜率,k杂质为依那普利杂质Ⅰ、杂质Ⅱ的线性方程斜率。本研究采用三台不同品牌的高效液相色谱仪器进行测定,其结果见表2。杂质Ⅰ与杂质Ⅱ的相对校正因子分别为0.71和0.92。杂质Ⅰ的相对校正因子与BP2018中杂质Ⅰ的相对校正因子一致。根据杂质研究相关技术指导原则,为确保杂质测定结果的准确可靠,一般情况下,校正因子在 0.9~1.1 时可不予校正,直接采用不加校正因子的自身对照法定量; 超出该范围,如采用主成分自身对照法的定量方式,须用校正因子进行校正,即加校正因子的主成分自身对照法,以保证杂质定量的准确性[8-9]。
表2 杂质Ⅰ、杂质Ⅱ 各仪器及各色谱柱下的校正因子
Tab.2 Thecorrection factors for impurity I and impurity II under the different instruments and columnsconditions
2.11样品测定
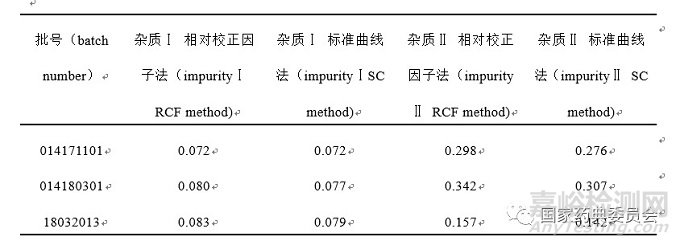
取马来酸依那普利片样品3批,分别采用标准曲线法和加校正因子的主成分自身对照法测定有关物质中杂质Ⅰ、杂质Ⅱ含量,结果如表3所示。经统计学软件t检验分析,采用加校正因子的主成分自身对照法与标准曲线法的测定结果基本一致。
表3标准曲线法与相对校正因子法测定结果比较(%,n=2)
Tab.3 The comparison of test results obtained with the standardcurve method and relative caliberation factor method
3、讨论
依那普利主要降解产物为依那普利拉和依那普利双酮,对于马来酸依那普利原料,其本身十分稳定,但是如果其产品控制不当,将特别容易降解产生依那普利拉和依那普利双酮这两种杂质,降解产生的依那普利拉口服吸收效果不佳,使得药品难以发挥药效,达不到降压的目的。因此在马来酸依那普利制剂过程中,对这两种杂质要予以检测。
本研究按照《中国药典》2015年版四部中“药品质量标准分析方法验证指导原则”的要求,对依那普利拉(杂质Ⅰ)和依那普利双酮(杂质Ⅱ)的校正因子进行测定,测定结果与BP2018吻合,提高了定量结果的准确性。本文不仅考虑到了色谱条件的耐用性,还通过使用3种不同品牌的仪器和色谱柱来验证本方法的仪器系统耐用性.结果不同仪器系统测得的相对保留时间和校正因子都具有较好的重现性,为马来酸依那普利片的质量控制提供参考,并为现行检测方法的完善提供了数据支持。
参考文献
[1] 刘浩.用HPLC法测定马来酸依那普利片的含量和有关物质[J].药学服务与研究,2003,3 (4) :247
LIU H. Determination of content of enalapril maleate and its related substances by HPLC method [J]. Pharm Care Res,2003, 11,3 (4) :247
[2] BP[S].2018:Ⅲ 545
[3] 中华人民共和国药典2015 年版.二部[S].2015:60
ChP 2010.VolⅡ [S].2015:60
[4] JP[S].2016 XVII 861
[5] 余振喜,庾莉菊,黄海伟.浅谈HPLC法测定有关物质时已知杂质的计算方法[J].中国药品标准,2011,11(4):278
YU ZX, YU LJ, HUANG HW. Discussionon the calculation methods of the known impurities in related substances determined by HPLC [J]. Drug Stand China 2010, 11 (4):278
[6] 刘敏,胡昌勤. 力达霉素标准品量值传递方法的研究[J].药物分析杂志,2004,24 (4) :380
LIU M,HU CQ. Study of a potency value transmission method for lidamycin reference standard [J]. Chin J Pharm Anal, 2004, 24 (4): 380
[7] 左文飞,潘娜,范雪平. 泮托拉唑钠杂质校正因子的测定[J].中国药学杂志,2012,47 (24):2029
ZUO WF, PAN N, FAN XP. Determination of correction of pantoprazole sodium impurity[J].Chin Pharm J, 2012, 47 (24):2029
[8] 化学药物杂质研究的技术指导原则[S].2005
Guidelines for research of impurities in chemical drugs[S]. 2005
[9] 刘琳,李慧,张菁,等.加校正因子的主成分自身对照法测定青霉素V钾片有关物质[J].中国药品标准,2017,18(1):29
LIU L, LI H, ZHANG J, et al. The method of main component self-control corrected with calibration factor was used for determination of related substances in henoxymethyl penicillin potassium tablets [J]. Drug Stand China, 2017, 18(1):29
《中国药品标准》杂志 2021年 第22卷 第1期
魏凯1,李欣2
1. 黑龙江天宏药业股份有限公司,哈尔滨 150035;
2. 哈尔滨市食品药品检验中心,哈尔滨150001

来源:《中国药品标准》杂志