一、MDR合规时间
1、合规时间图
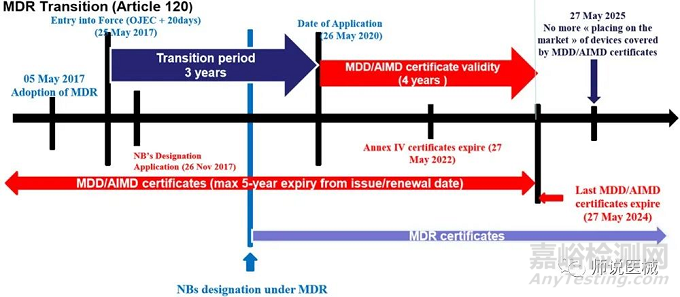
特别说明的是,由于COVID-19疫情的影响,MDR实施日期推迟到2021年5月27日。
1) 从2021.5.26开始,任何公告机构不能再签署MDD、AlIMD的CE证书;2) 在MDR生效前获得MDD 和AlMD CE证书,在其5年有效期内继续有效。3)2017.5.26至2021.5.25期间,仍可申请MDD证书,有效期5年,但不能超过2024.5.27(MDD附录V路径和AIMD附录4路径获得的证书最迟在2022.5.27日失效)4) 但上条所述日期之前已投放到欧盟市场的产品,可继续销售和使用到2025.5.27。
5)从2024.5.27开始,产品不能再持有MDD证书清关投放市场,但在此之前已投放市场的产品,可继续销售和在客户端使用至2025.5.27日; 6) 2020.5.26日后,产品上市后的监督管理等活动,必须遵守MDR指令的要求;
7)如果MDD下的产品在2025.5.27前还没有交付使用,则2025.5.27之后,GAME OVER。即便是已经进入欧盟了,只要还没交付给医院使用,医院也不能再接收。8)由于2021.526日起,任何公告机构不能再签署MDDAIMDCE证书,故在之后继续使用MDDAlMDCE证书的制造商应确保·CE证书上任何内容不再发生变化,如新类别,新场地等。·已上市产品没有设计和预期用途上的重大变更,也不能同类别增加新型号。如变化,必须重新申请MDR证书。1)对于原来是自我声明模式,在MDR法规时候变更为公告机构参与合格评定模式的,其合规日期为2024年5月27日; 2)对于在新旧法规均为自我声明模式的I类器械,建议从2021年5月27日开始就按照MDR法规来准备合规证据。
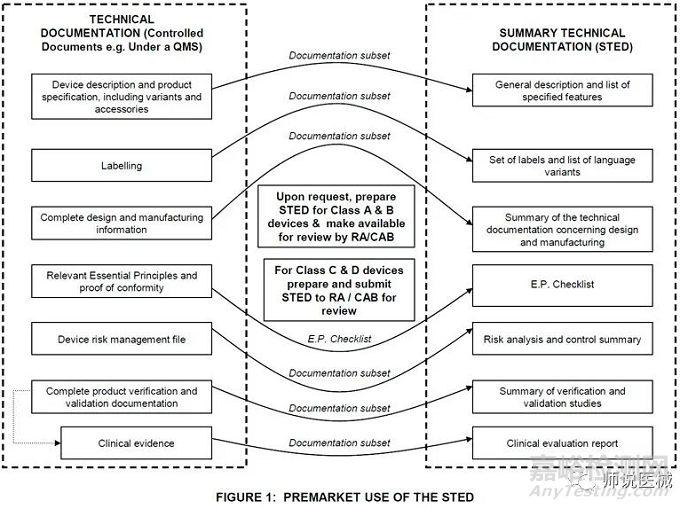
STED是由原GHTF编制的对于技术文件编写结构的指南。
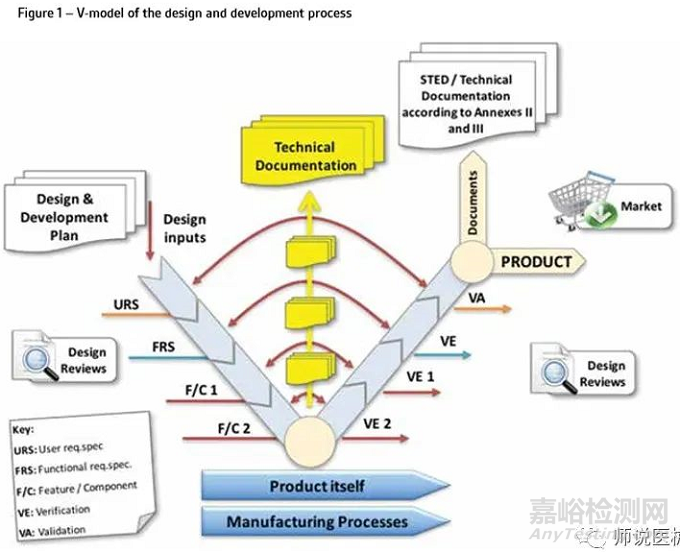
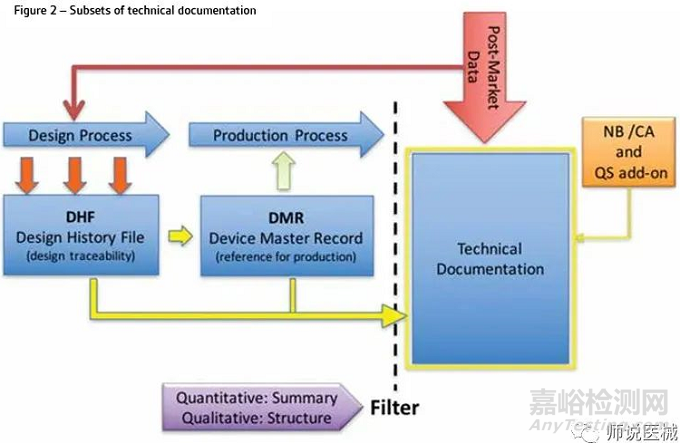
技术文档必须在设备的设计和开发过程中形成,并在整个生命周期中进行维护。如图1所示,这个过程可以使用V-mode表示,因为它交付文档和记录,这些文档和记录形成了设计历史文件(DHF)。技术文档代表描述设备的所有文档。因此,它包括设备的设计、开发、V&V(包括临床和性能验证)以及它在目标市场的监管地位。此外,MDR现在需要一个闭环的过程,实现数据从上市后使用设备(PMS),为了确保捕获早期预警的总体安全性和性能需求(GSPRS)2不断满足和对病人的好处总是大于风险。应以结构化的方式,以促进NB审查和评估(图2)的方式呈现技术文档。这意味着技术文档的编制需要的应用定量和定性过滤器允许一个适当的水平的细节保持,同时避免将多余的细节没有必要证明满足GSPRS。(a)法规符合性战略,包括符合性评估流程的符合性和系统所涵盖的器械的变更管理程序;(b)确定适用的通用安全与性能要求,寻找可选择的满足这些要求的方法;(f)临床评价,根据第61条和附录XIV的规定,包括PMCF;(g) 产品实现规划,包括规划、设计、研发、生产和服务提供;(h)根据第27(3)条规定验证所有相关器械的UDI分配,确保根据第29条提供的信息的一致性和有效性;(j)根据第83条的要求,建立、实施和维护上市后监管体系;(k)与主管机构、公告机构、其他经济运营商、客户和/或其他利益相关人沟通;(l)警戒情况下的严重事件和现场安全纠正措施的报告流程;
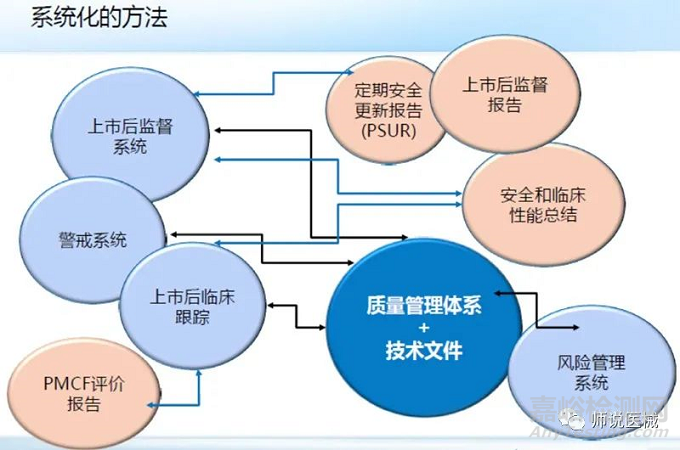
MDR更加重视对于上市后的监管要求,相关方需要建立:所有这些,都应在质量管理体系和技术文件中加以体现。
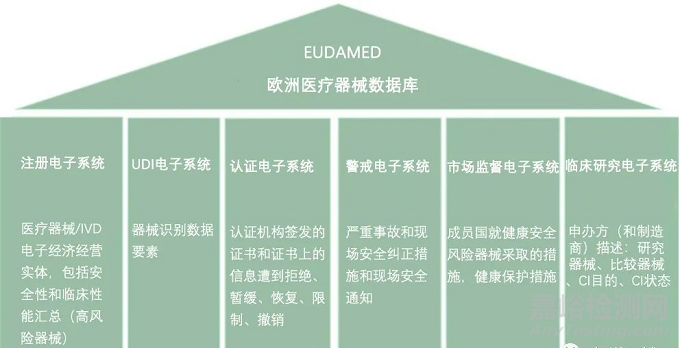
Actors模块是第一个需要填写的模块。每个行为人必须输入明确的数据,如姓名、地址、网站等,此外,识别和联系法规符合性人员的详细信息需要与行为人的数据一起输入。非欧洲制造商也必须输入此数据,因此必须向其所在成员国的主管当局申请SRN,并在那里注册其UA。他们的AR需要先在Eudamed注册。对于初始注册,无需输入AR代表的非欧洲制造商的名称。下一步,非欧洲制造商在其注册过程中指定AR,之后AR验证该注册过程。
-
您的器械目前是l类自我声明,但在MDR下需要NB的
-
-
-
-
-
在2020-2022期间计划引入新产品
-
器械有充分的临床证据
-
遵循MDD或者AIMDD的附录lV
-
预期您的NB继续在医疗器械活跃
如果您的器械是以下的,建议选择Option 3:
如果您的器械是以下的,建议选择Option 4:
-
需要转换的器械很多,并且没有内部时间来同时处理它们
-
有多种器械,其中一些具有出色的临床证据,另一些则需要更多数据
-
您将在未来几年推出新产品,并致力于对现有遗留器械进行重新认证