您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-25 08:51
本文继续分享设计控制的一个重要元素,设计开发输出。
法规的要求
QSR820
820.3(g)
Design outputs means the results of a design effort at each design phase and at the end of the total design effort.
820.3(g)设计输出是指各设计阶段的设计成果和最终的总设计成果。完整的设计输出包括器械,包装和标签,器械主记录。
820.30(d) Design output
Each manufacturer shall establish and maintain procedures for defining and documenting design output in terms that allow an adequate evaluation of conformance to design input requirements. Design output procedures shall contain or make reference to acceptance criteria and shall ensure that those design outputs that are essential for the proper functioning of the device are identified. Design output shall be documented, reviewed, and approved before release. The approval, including the date and signature of the individual(s) approving the output, shall be documented.
820.30 (d)设计输出
制造商应建立、维护用于定义和编制设计输出文件的程序,以便充分地进行设计输出是否满足设计输入要求的评价。设计输出程序应包含或索引到可接受准则并确保为器械正常的工作必不可少的设计输出被识别出来。设计输出应形成文件、进行审评并在批准后生效。同步记录审评、批准人员和批准日期信息。
ISO 13485
7.3.4 Design and development outputs 设计和开发输出
Design and development outputs shall:
a) meet the input requirements for design and development;
b) provide appropriate information for purchasing, production and service provision;
c) contain or reference product acceptance criteria;
d) specify the characteristics of the product that are essential for its safe and proper use.
The outputs of design and development shallbe in a form suitable for verification against the design and development inputs and shall be approved prior to release.
Records of the design and developmentoutputs shall be maintained.
设计和开发输出应:
a. 满足设计和开发输入的要求;
b. 提供适当的信息给采购,生产,服务;
c. 包括或引用产品接收准则;
d. 规定产品特性,该特性对于产品的安全和正确使用是必需的。
设计和开发的输出应采用适合于对照设计和开发输入进行验证的形式,并应在发布前获得批准。应保存设计和开发输出的记录。
China GMP
第三十一条 设计和开发输出应当满足输入要求,包括采购、生产和服务所需的相关信息、产品技术要求等。设计和开发输出应当得到批准,保持相关记录。
第三十二条 企业应当在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
法规的解析
共同点
设计开发输出应该被记录。
设计开发输出应该满足设计开发输入的要求。
差异点
QSR820 特有要求
为确保器械正常的工作必不可少的设计输出被识别出来
QSR820/ISO13485
设计开发输出应包括或引用产品接收标准
ISO 13485
识别规定产品特性,该特性对于产品的安全和正确使用是必要的。
ISO 13485/China GMP
设计开发输出包括采购、生产和服务所需的相关信息。
China GMP
设计开发输出包括产品技术要求;设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
设计开发输出
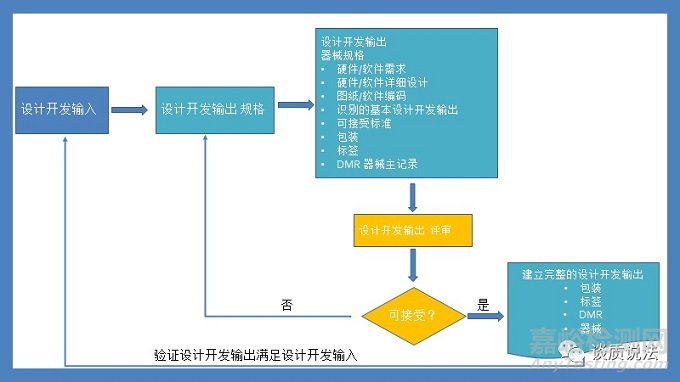
设计开发输出既有文件层面的各个低层次的需求,详细设计,图纸,软件编码,包装,说明书,标签等,也有如以实物形式存在的系统,子系统,零件,包装箱等。
我们经常说的“设计输出(design output)”,比如研发部门做出来的设计方案、机械图纸、电路图、软件代码,实际上是狭义的Design Output!真正意义上 的 Design Output 还包括用于生产的DMR(Device Master Record)。这个广义的概念也正是开篇中FDA 要求中说到的 “total finished design output”。
一般而言DMR可能包括:
DMR目录
产品技术规格
原理图
部件清单
采购文件(包括部件规格等)
生产过程规范(制造工艺SOP,组装作业指导书,连接示意图,软件配置等)
标识信息(清洁方法,存储条件,安全和警告标签)
产品控制文件(检验规程以及可接受准则)
包装规格
安装和维护信息

来源:谈质说法


