您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-26 18:48
医疗器械降解测试设计原则
1. 总原则
一般来说,降解测试的评估方法主要由三个因素决定:1)材料特性;2)器械种类;3)器械使用的解剖学位置。但是,不管考虑什么因素,所选的评估模型一定要能代表器械的使用环境。
2. 初步考虑
通过了解材料化学特性、已知的降解机制或者开展降解试验,来仔细评估材料潜在降解的可能性,这是初步考虑的关键所在。当然,并不是所有的医疗器械都要开展降解产物研究。在标准附录A中,有提供决策流程图供大家参考,小编认为可以总结成三个问题:1)通过文献和临床经验数据检索,产品材料有无降解的可能性;2)降解特性是否和已知的上市产品等同;3)考虑材料种类,是否有匹配的标准,如ISO 10993-13、ISO 10993-14、ISO 10993-15。
ISO10993系列标准下载地址http://www.anytesting.com/data/q-10993.html
3. 试验设计
在试验展开之前,要制订生物降解研究计划。该计划应重点关注 “1.总原则”中提到的三个因素,并定义相关分析方法来研究降解产物的下列特征:1)理化性质;2)表面形态;3)生化特性。此外要注意的是,对于含多种材料的医疗器械,研究计划应考虑不同材料降解产物间的协同效应以及二次反应的可能性。
4. 医疗器械降解产物特性
由于在测试过程中产生的降解产物可能是颗粒、可溶性化合物或离子,所以在研究中应明确并验证用于表征的分析方法。如果降解产生颗粒,则需要在尺寸、形状、表面积等方面进行表征。嘉峪检测网建议如果需要对降解产物进行生物评估,则应考虑:1)设备、材料和预期用途的识别和表征;2)可能的降解机制;3)已知、可能和潜在降解产物的识别和表征;4)测试方法。降解产物的释放程度和速率取决于很多因素,例如制造工艺改变,导致材料表面组成和结构、生理环境中的溶解度发生变化等。
5. 研究报告
一般而言,研究报告应至少包括以下信息:1)器械和材料描述,包括预期用途和身体接触特性;2)降解评估及标准;3)降解测试方法、试验条件、试验材料、对照品和试验过程的描述;4)分析方法描述,包括定量限等;5)符合实验室规范质量管理体系的声明;6)降解产物定性和定量;7)结果摘要;8)对结果的解释和讨论;9)原始数据记录;10)保密协议;11)试验偏离说明。
医疗器械降解测试方法
有两种两种产生降解产物的测试方法:一种是作为筛选方法的加速降解测试,另一种是模拟环境中的实时降解测试。但两种情况都仅针对不可再吸收的聚合物。
1. 基本考虑:
试验设计
如果在加速测试中,观察到降解现象但不足以提供数据支撑,则需开展实时测试,因此加速测试可以作为筛查目的。如果没有观察到任何降解现象,则无需开展实时测试。另外,样本制备应符合ISO 10993-12标准要求。
初始材料表征
用于初始材料表征的分析方法要适用于所研究的聚合物材料,标准附录A列举了部分分析方法,大家可参考下表。但要注意的是,由于产品可能包含多种材料,所以厂商要开展详细的文献研究,并要求供应商提供可靠的数据支撑。

测试溶液和装置
测试溶液应尽可能与聚合物预期使用环境相一致,如果无法模拟使用环境,则要分两种情况考虑:1)用于水解降解的测试溶液:用符合ISO 3696的二级分析实验室用水或缓冲液;2)用于氧化降解的测试溶液:水和过氧化氢混合溶液(如符合药典要求的3%过氧化氢溶液),或者是芬顿试剂(稀释的过氧化氢溶液和二价铁盐的混合物,如100μmolFe2+和1mmol H2O2)。
根据测试溶液,应使用封闭的化学级玻璃器皿,如聚四氟乙烯或聚丙烯容器。应使用控制装置来评估容器中的污染物,并提供证据证明容器不会干扰分析。
其它考虑
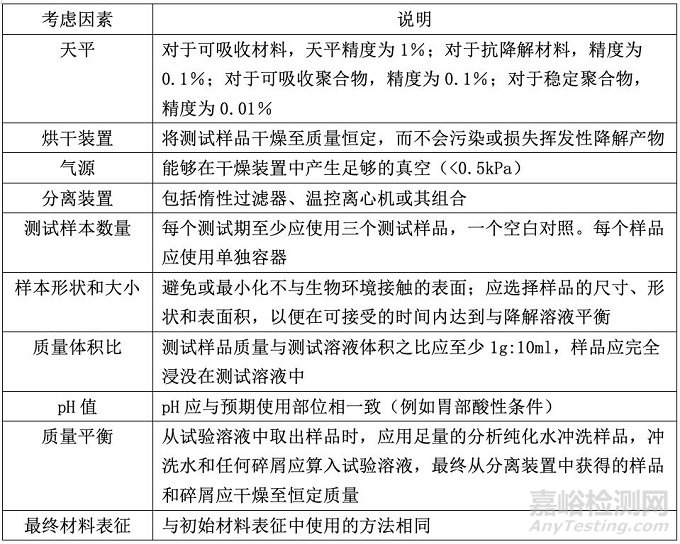
2. 加速降解测试

3. 模拟环境中实时降解测试

器审中心关于部分医疗器械降解试验的答疑:
1、对于可降解/吸收的植入性医疗器械产品,能否提供研究机构公开发表的文献作为产品降解性能的研究资料?
答:对于成熟材料,申请人可提交第三方公开发表文献作为降解产物代谢研究的支持性资料,但由于产品降解周期研究中的性能指标、观察时间点等要素与产品设计相关,因此申请人应对产品降解周期开展实验研究。
2、可吸收止血产品体外降解试验需考虑的因素有哪些?
答:可吸收止血产品进行体外降解研究时,建议模拟体内条件(例如:37℃的环境下,蛋白水解等)研究产品完全吸收降解所需时间及所有的降解产物。建议结合产品特性及临床应用建立合理的体外降解研究方法。建议参照已有的标准方法并与已上市的同类产品进行比较。体外降解研究建议观察指标包括:产品溶解性、降解周期、降解所需的条件及降解速度与降解条件之间的关系,降解的主要产物及含量、形态改变(崩解过程、是否有碎片掉落、碎片溶胀等)。
3、整形用注射透明质酸钠凝胶是否要求体外降解试验,具体要求是怎样的?
答:参考YY/T 0962-2014《整形手术用交联透明质酸钠凝胶》,对于整形用注射透明质酸钠凝胶,建议在产品技术要求中制订体外降解试验要求,以对透明质酸钠凝胶的降解性能起到质量控制的作用。建议设置数个观察时间点,观测至透明质酸钠凝胶完全降解,对于不同时间点的降解程度需制订上下限要求。体外试验可通过调节降解酶的浓度等试验条件实现加速降解。

来源:嘉峪检测网


