您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-09-16 10:43
以下内容整理自国家市场监督管理总局食品审评中心
Q1、对于要求重做的试验项目,受试样品的产品批号必须与原申报资料产品批号保持一致吗?
A: 原则上应该使用同一批样品进行试验,如果原来的样品已超过产品的保质期,可以使用另一批号的样品,但应说明理由。
Q2、内包装材料质量要求应提供那些资料?
A: 根据国食药监注[2005]203文件的要求,包装应符合食品容器及包装材料的卫生标准的规定或药品包装的相关要求,提供相应的证明及其质量标准。包装项下应列出该产品的包装规格(包括单件包装规格等)、包装材料的名称及其质量要求等项目,其中包装材料的名称应为规范的名称,提供相应的材料说明及其质量标准的具体名称和标准号(无相应标准的除外)。还应注意包装材料与所用包装工艺是否一致。
Q3、如何制定和选择保健食品原辅料质量标准?
A: 根据《保健食品注册管理办法(试行)》的规定,保健食品所使用的原料和辅料应符合国家标准和卫生要求。无国家标准的,应提供行业标准或自行制定的质量标准。
Q4、功效成分及含量应如何描述?
A: 功效成分或标志性成分的选择应在产品的研制基础上进行,可根据产品配方、保健功能、生产工艺的不同选择不同的功效成分或标志性成分。 功效成分或标志性成分确定的依据为:
(1)产品研制生产中原料投入量;
(2)加工过程中功效成分或标志性成分的损耗;
(3)多次功效成分或标志性成分的检测结果;
(4)该功效成分或标志性成分检测方法的变异度;
(5)国内外有关该功效成分或标志性成分的安全性评价资料。
若产品仅有一种功效成分或标志性成分,可直接以文字陈述其规定;若有两种或两种以上功效成分或标志性成分,应列表标示其项目和指标;对于现代科学技术难以明确功效成分或标志性成分的产品,应标明起主导作用和辅助作用的原料名称及加入量。
Q5、功效成分含量必须以稳定性试验最低值标识吗?
A: 功效成分含量指标值的确定应在产品的研制基础上进行,且由申请人自行提出。功效成分或标志性成分的指标值应按下列方法标示:
(1)功效成分或标志性成分一般按≥指标值标示,如总氨基酸、粗多糖、总黄酮、总皂苷、膳食纤维等;
(2)需要制定范围值的功效成分或标志性成分,可按指标值±X%作为限定范围,如总蒽醌、芦荟苷、维生素、矿物质等成分。X值的大小依据研制产品的检测资料及有关食品安全性资料确定;
(3)对于每日摄入量需严格控制的功效成分或标志性成分,如褪黑素等,其指标值的标示范围应以每日用量为依据,上限不得大于允许摄入量。
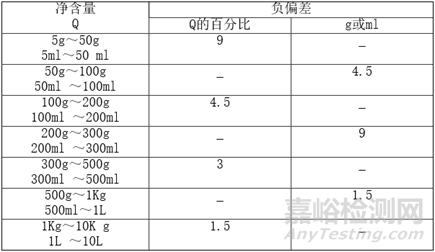
Q6、净含量及允许负偏差如何确定?
A: 按照GB16740确定单件定量包装(最小销售包装)允许负偏差的范围,注意允许负偏差的标识值。净含量及允许负偏差应按照GB16740-1997《保健(功能)食品通用标准》的规定,列表标示产品最小销售包装的净含量及允许负偏差,而不是每片、每粒或每支的净含量及允许负偏差。净含量的单位可标示为g/盒、mL/盒、g/袋等。
参考如下:
Q7、银杏叶提取物中银杏酸指标要限量吗?限值是多少?
A: 银杏酸属漆酚酸类混合物,在银杏叶和外种皮含量较高,常规的提取和加工工艺不能有效的去除银杏叶提取物中的银杏酸。经广泛的药理学、毒理学研究,银杏酸具有强烈的致敏作用和细胞毒性。其食用安全性已经引起全世界的广泛关注。德国、美国、法国及其他欧州国家相继制定了银杏叶提取物中银杏酸指标限量,《中华人民共和国药典》(2005年版)也对用于口服制剂的银杏叶提取物中该指标限量做了规定。
参照《中华人民共和国药典》(2005年版)中用于口服制剂的银杏叶提取物中该指标限量,及德国中草药提取物国家标准、《法国药典》、美国联邦食品与药物管理局银杏叶提取物质量标准、国际市场相关规定,并经对我国银杏叶提取物的质量概况进行充分的调查和研究,确定以银杏叶提取物为原料申报的保健食品,在银杏叶提取物质量标准中增加银杏酸指标,其限量不得超过10ppm。
Q8、鲜蜂王浆、益生菌类产品如何设计稳定性试验?
A: 按照《保健食品稳定性试验指导原则》的要求,对贮存条件有特殊要求的样品,如益生菌类、鲜蜂王浆类产品,应在说明书规定的贮存条件下进行稳定性考察。保质期在3个月之内的,应在贮存0、终月(天)进行检测;保质期大于3个月的,应按每3个月检测一次(包括贮存0、终月)的原则进行考察。
Q9、保健食品中大肠菌群指标的检测方法应如何选择?
A: 《卫生部关于规范食品中大肠菌群指标的检测工作的公告》(2009年16号)中规定:现行食品标准中规定的大肠菌群指标以“MPN/100克或MPN/100毫升”为单位的,适用《食品卫生微生物学检验 大肠菌群测定》(GB/T4789.3-2003)进行检测;以“MPN/克或MPN/毫升”、“CFU/克或CFU/毫升”为单位的,适用《食品卫生微生物学检验 大肠菌群计数》(GB/T4789.3-2008)进行检测。
《保健(功能)食品通用标准》(GB 16740-1997)规定的保健食品中大肠菌群指标单位为MPN/100克或MPN/100毫升。因此,保健食品中大肠菌群的检测适用《食品卫生微生物学检验 大肠菌群测定》(GB/T 4789.3-2003)规定的方法。
Q10、应如何选择和确认保健食品益生菌类标志性成分检测方法?
A: 鉴于现行的益生菌检测方法国家标准和国际标准基本能够满足保健食品益生菌检测需要,且国家标准和国际标准检测方法稳定、复现、适用,目前暂不将益生菌类标志性成分检测方法学研究资料作为强制性要求,但注册申请人选择和确认的检测方法应符合以下国家标准或国际标准:
(一)检测菌种在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内的益生菌产品,检测方法必须采用GB 4789.34或GB 4789.35规定的方法。
(二)检测菌种不在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内,且检测方法无法采用GB 4789.34或GB 4789.35规定方法的产品,可采用AOAC微生物检验方法体系、USDA微生物检验方法体系、IDF微生物检验方法体系、FDA Bacteriological Analytical Manual(BAM)及ISO 16140规定的方法。
(三)检测菌种不在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内,且采用自行制定的检测方法的产品,应提供检测方法选择和确定的依据,与上述国际微生物检验方法体系相应方法的三批产品检测结果比对。

来源:Internet


