您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-05 19:35
目的: 对我国暂停的药物临床试验进行深入分析, 探讨暂停试验的基本特征和主要原因, 为申办方、研究机构和审评机构提供科学决策依据。
方法: 收集药物临床试验登记与信息公示平台的暂停试验信息, 对暂停试验的药物类型、试验范围、适应证类型、试验备案时间、临床试验分期、试验中心分布及暂停原因等进行分析。
结果: 截至2023年12月31日, 该平台暂停临床试验项目448项, 约占总登记项目的10.65%。暂停试验以化学药品为主(70.76%), 其次为生物制品(20.98%)和中药/天然药物(8.26%)。从临床试验分期来看, 生物等效性试验暂停最多(35.04%), 其次为Ⅲ期(23.66%)、I期(20.54%)和Ⅱ期(19.20%)临床试验。国内临床试验(83.04%)暂停比例高于国际多中心临床试验(16.96%)。暂停试验涉及的主要适应证包括肿瘤(25.22%)、心血管及血液系统疾病(18.53%)、免疫及抗感染(10.71%)等。暂停原因中, 企业开发计划及资金问题最为突出(32.59%), 其次为试验结果未达预期(21.88%)和试验方案调整(12.72%)。不同类型药物和试验分期的暂停原因存在差异, 如生物等效性(BE)试验暂停多因试验结果未达预期, 而I~Ⅲ期临床试验则主要受企业开发计划及资金影响。
结论: 药物临床试验暂停现象在我国较为普遍, 其主要原因包括企业开发计划及资金问题、试验结果未达预期等。因此, 申办方、研究机构和审批机构需加强对临床试验的监管及管理, 优化资源配置, 减少不必要的试验暂停, 以保障受试者的权益并促进药物研发高效进行。
关键词
临床试验; 暂停试验; 原因
正文
随着新药研发的不断推进, 药物临床试验作为新药上市的关键环节, 其重要性日益凸显。近年来, 我国药物临床试验数量快速增长, 2023年药物临床试验登记与信息公示平台登记临床试验总量达4206项, 较2022年登记总量增长了26%。临床试验数量激增的过程中, 临床试验暂停现象也时有发生。临床试验的暂停不仅影响了项目的进度和成本, 还可能对药物研发的整体策略产生深远影响。本文基于药物临床试验登记与信息公示平台的数据, 对截至2023年12月31日备案的药物临床试验中暂停的项目进行深入分析, 旨在探讨暂停试验的特征和原因, 为申办方、研究机构和审评机构提供决策参考。
资料与方法
1 资料来源
本研究数据来自药物临床试验登记与信息公示平台(http: //www. chinadrngtrials. org. cn, 以下简称“CDE公示平台”), 检索条件: 试验状态为“主动暂停”“IECIRB暂停”“责令暂停”, 检索时间自建库开始至2023年12月31日, 国家药品监督管理局药品审评中心(CDE)公示平台检索到的所有药物临床试验数据。
2 研究方法
收集和分析药物临床试验暂停的基本情况, 包括药物类型、试验范围、适应证类型、试验备案时间、临床试验分期、试验中心分布和暂停原因等。其中适应证类型按照《国际疾病分类》第10版(lnternational Classification of Diseases 10th Edition, ICD-10)的疾病分类标准分类。利用Microsoft Excel进行数据整理, 通过SPSS27.0软件进行数据分析, 采用Krnskal-Wallis H检验对不同分类下的数据差异进行显著性检验。
结果
1 药物临床试验暂停概况
截至2023年12月31日, 我国药物临床试验登记与信息公示平台共登记4206项药物临床试验, 其中试验状态为暂停的临床试验共计448项, 约占总登记项目的10.65%。根据CDE公示平台主动暂停试验信息, 本文将试验主动暂停的原因分为: 企业开发计划及资金146项(32.59%), 试验结果未达预期98项(21.88%), 试验方案调整57项(12.72%), 监管政策原因影响37项(8.26%), 入组进度及受试者招募困难31项(6.92%), 研究医院和中心实验室等合作方原因30项(6.70%), 试验用药品等28项(6.25%), 安全性问题15项(3.35%), 不可抗力影响6项(1.34%)。
暂停临床试验从药物类型来看, 化学药品317项(70.76%), 生物制品94项(20.98%), 中药/天然药物37项(8.26%)。从临床试验分期来看, 生物等效性(bioeqnivalency, BE)试验157项(35.04%), 其次依次是Ⅲ期临床试验106项(23.66%), I期临床试验92项(20.54%), Ⅱ期临床试验86项(19.20%), Ⅳ期临床试验5项(1.12%), 其他(中医临床试验) 2项(0.45%)。从临床试验范围来看, 国内临床试验372项(83.04%), 国际多中心临床试验76项(16.96%)。根据暂停试验所涉及的适应证来看, 主要包括肿瘤113项(25.22%), 心血管及血液系统83项(18.53%), 免疫及抗感染48项(10.71%), 神经系统45项(10.04%), 内分泌及代谢系统37项(8.26%), 消化系统32项(7.14%), 泌尿生殖系统27项(6.03%), 呼吸系统26项(5.80%), 运动系统17项(3.79%), 其他系统20项(4.46%)。
2 不同药物类型临床试验暂停原因的差异
从药物类型来看, 化学药品(70.76%)和生物制品(20.98%)的暂停比例显著高于中药/天然药物(8.26%)。不同药物类型分类下的暂停原因统计见表1。化学药品和生物制品的暂停首位原因都是企业开发计划调整, 这一比例在生物制品中最高(40.43%)。相比之下, 中药/天然药物虽然总体暂停数量较少, 但试验方案调整成为其暂停的主要原因(32.43%)。
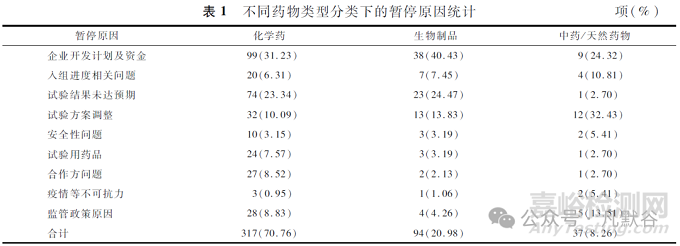
3 不同试验分期的暂停原因差异
剔除中药试验后, 不同试验分期下暂停原因统计见表2。BE试验首要暂停原因为试验结果未达预期(29.24%), I~Ⅲ期临床试验暂停的首要原因为企业开发计划及资金问题, 但随着试验阶段的推进, 试验结果未达预期成为更主要的暂停原因, 特别是在Ⅲ期临床试验(28.30%)。随着研发推进, 对药物疗效和安全性的要求也更高, 任何不符合预期的研究结果都可能导致试验暂停。此外, 安全性问题在I期临床试验中尤为突出(8.70%)。
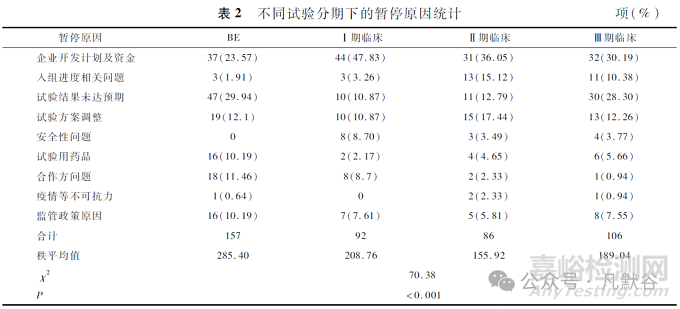
4 不同试验范围临床试验暂停原因差异
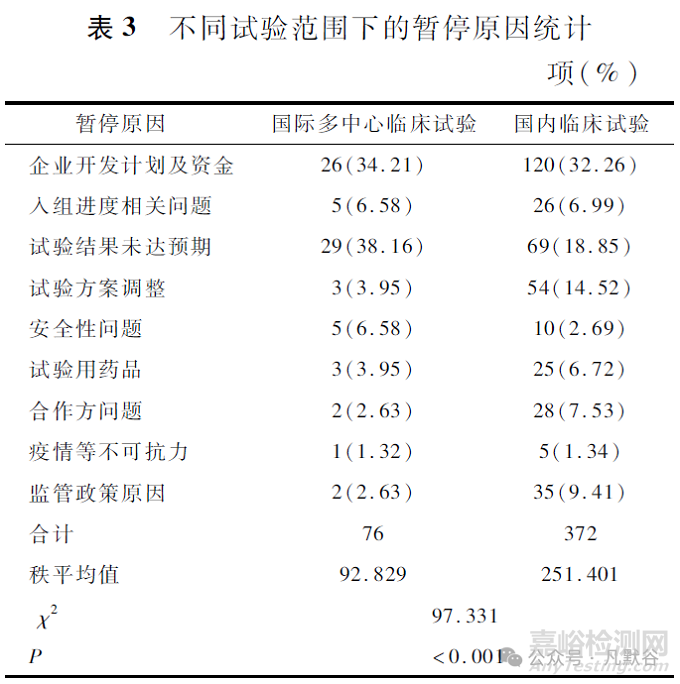
国际多中心临床试验与国内临床试验在暂停原因上的差异见表3。国内多中心临床试验企业开发计划及资金仍然是导致试验暂停的主要原因(32.26%), 而国际多中心临床试验导致试验暂停的主要原因是试验结果未达预期(38.16%)。相比之下, 国内临床试验因试验方案调整而导致暂停的比例(14.52%)也比国际多中心临床试验高(3.95%)。
讨论
本研究揭示了我国药物临床试验中暂停现象的普遍性, 约占总登记临床试验总数的10.65%, 这一比例反映了在新药研发过程中面临的复杂性和不确定性。临床试验的暂停不仅直接影响了药物的研发进度, 还可能对受试者造成心理上的不安, 加重原有疾病的潜在风险, 如中断治疗可能导致的病情波动。因此, 深入理解暂停试验的特征和原因, 对于优化临床试验管理、保障受试者权益及加速新药上市具有重要意义。
新药研发周期长、投入大, 企业需具备稳定的资金链和合理的规划。本研究中, 企业开发计划及资金在所有暂停的试验中占比最高(32.59%)。资金短缺或项目开发计划调整不当, 都可能使临床试验难以为继。此外, 市场策略、竞争格局的变化也可能影响企业的研发投入和优先级, 导致某些项目被迫暂停。热门临床研究的靶点竞争激烈且趋于同质化, 随着首款研发药品降价进入医保目录, 产品尚在研发途中的科技型初创企业, 产品如果没有明显优于同靶点竞争对手的不可替代的临床价值, 有可能失去存活的机会。新药研发除了关注热门靶点, 还需要关注患者临床需求是否得到充分满足, 应以患者为中心, 为患者提供更优的治疗方案和体验为最高目标开展。
试验结果的有效性和试验方案的调整反映了试验设计的科学性和可操作性。当试验设计存在缺陷或无法达到预期效果时, 暂停试验以重新评估和调整方案是必要的。同时, 试验执行过程中的管理问题, 如入组进度缓慢也可能成为暂停的原因。药物安全性是临床试验不可忽视的方面, 当试验过程中出现严重不良事件、非预期的不良事件或其他安全性问题时, 出于对患者权益的保护, 试验可能会被暂停以进行进一步的安全评估。独立的数据监查委员会(Data Monitoring Committee, DMC)在临床试验中起到十分重要的决策作用, 通过定期对临床试验的进展、安全性数据和重要的有效性终点进行评估, 向申办者建议是否继续、调整或者停止试验。尤其是一些复杂的适应性设计, 中期队列选择、样本量变更、终点指标调整等, 都需要DMC参与和决策, 保证受试者利益, 提高试验的完整性和可靠性。
临床试验作为新药研发的关键环节, 因其复杂性要求多方紧密合作, 包括研究中心、中心实验室、申办者、伦理委员会以及数据管理和统计单位等。多方协作模式虽然能够有效整合资源, 但也带来了协调不畅和资源分配不均等潜在问题, 这些问题往往成为影响临床试验进度乃至导致其暂停的重要因素。随着多中心临床试验项目数量的增多, 中心实验室的地位在药物临床试验中变得愈发重要。研究中心与中心实验室之间在样本处理、数据收集与报告等环节缺乏有效沟通时, 可能会导致数据质量下降, 甚至延误临床试验的关键节点。申办者与研究中心在临床试验方案设计、实施、伦理审查及受试者招募等方面的协调不足, 也可能使得临床试验方案频繁调整, 进而影响临床试验进度。公示的暂停原因中, 常见的BE试验暂停原因是研究中心试验安排太满, 无法提供现有临床试验的充足排期。此外, 合作方的资质、能力和信誉也是影响临床试验顺利进行的重要因素。
随着医药产业的快速发展, 监管政策不断调整, 对临床试验的要求日益严格。临床试验数据核查力度加强, 促使企业更加重视试验的合规性和数据质量, 避免因不合规而导致的试验暂停或失败。这一趋势也促使行业内部加强自律, 提升临床试验的整体质量和效率。
突发公共卫生事件不仅直接导致了临床试验的延期和暂停, 还加剧了受试者招募和试验实施的难度, 给整个医药研发领域带来了前所未有的挑战, 更是凸显了去中心化临床试验(digitalized clinical trials, DCT)潜在价值和实施必要性。DCT通过利用远程招募注册登记、远程知情同意、移动医疗、可穿戴设备、远程视频访视/随访、药物直达患者等方式, 使得临床试验能够在更广泛的地域和人群中开展, 降低了传统临床试验对物理场所和人员的依赖。DCT模式进一步提高临床试验的韧性和适应性, 为医药产业的持续发展和创新提供更加坚实的支撑。
综上所述, 药物临床试验的暂停是一个复杂的过程, 涉及多种因素的综合作用。不同药物类型、试验分期和试验范围下的暂停原因存在显著差异, 在临床试验管理中需要采取更加精细化和差异化的策略。针对企业开发计划及资金这一普遍性问题, 需要加强资金管理和风险防控机制, 确保研发项目的持续性和稳定性。同时, 针对不同试验阶段和范围的试验药物, 建议临床试验合作各方制定相应的应对措施和管理规范, 以提高临床试验的效率。此外, 还应加强对受试者的保护和关怀, 确保其在临床试验中的权益得到充分保障, 减少暂停现象的发生, 加速新药研发进程。

来源:Internet


