您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-07-27 09:23
本技术报告(Technical Report,TR)旨在为制药工艺验证(PV)生命周期方法的实施提供实用指南。它包含的信息能够使生产厂家实施全球认可的工艺验证程序,该程序与最近的基于生命周期的工艺验证指导文件和现行对药品质量系统期望相一致。在医药生产中,“工艺验证”是收集和评价工艺设计阶段的数据,通过商业化生产的方式确定科学的证据,证明一个工艺能够持续地提供高质量的产品。美国 FDA 和欧洲药监局认定 PV 在现行 GMP 指南的综述和具体条框中都是必要条件和药品质量保证的必需元素。
工艺验证生命周期概念连接产品和工艺开发、商业化生产确认和协同努力下商业化生产过程的维持。当基于良好的工艺理解和使用质量风险管理时,生命周期法可考虑生产者在使用传统的工艺验证外,再使用连续工艺确证(增强的方式),或者直接由后者代替前者。
在本技术报告中应用于药物和药品生产过程的信息,包括:
无菌和非无菌药物
生物技术/生物产品,包含疫苗
原料药(APIs)
放射性药物
兽药
组合产品的药物成分(如,复方抗菌药和医疗器械)
这份报告是为全球使用和应用到新的和现有的(即遗留的)商业生产过程做准备。它的范围不包括:
生产的生产过程如下:医疗器械,膳食补充剂,药用物料,人体组织。
尽管这些产品分类超出了这份 TR 的范围,但它的建议是基于现代质量思想的/ICH质量指南和最近的监管机构权威指导性文件。因此,它可能在其他产品类别的工艺验证生命周期法的开发中是有用的参考文献。药物生产过程中的辅助操作的验证在这个报告中不做讨论。一些 FDA 的技术报告已经提供了此类操作规程的具体指导性文件;如:清洁、无菌过程模拟、湿热灭菌和干热灭菌。
工艺知识的建立和获取(第一步-工艺设计)
本节集中于开发过程中所用的方法以实现具耐受性的生产工艺,它解决了工艺验证第一阶段中工艺和产品知识被开发以建立控制策略。风险评估和管理被使用以集中于研发工作。工艺和产品知识通过药物研发方案逐步形成。为对工艺验证用生命周期方法而设计一个综合的、有效的程序/方案强迫在研发非常早期考虑规划。早期规划便于在阶段 1 收集恰当数据,加强阶段 2 商业工艺确认的有效性和成功的目标,它也为阶段 3 持续工艺确证建立一个基础。
工艺验证生命周期阶段 1 之前(以及可能在过程中)可利用知识来源包括:
类似工艺(例如平台工艺)的以往经验;
产品和工艺理解(从临床和临床前活动);
分析的特征描述;
已发行的文献;
工程研究/批;
临床生产;
工艺研发和特征研究;
下面章节概述了工艺验证一般生命周期方法中阶段 1 的输出,描述在图 3.0-1 中。
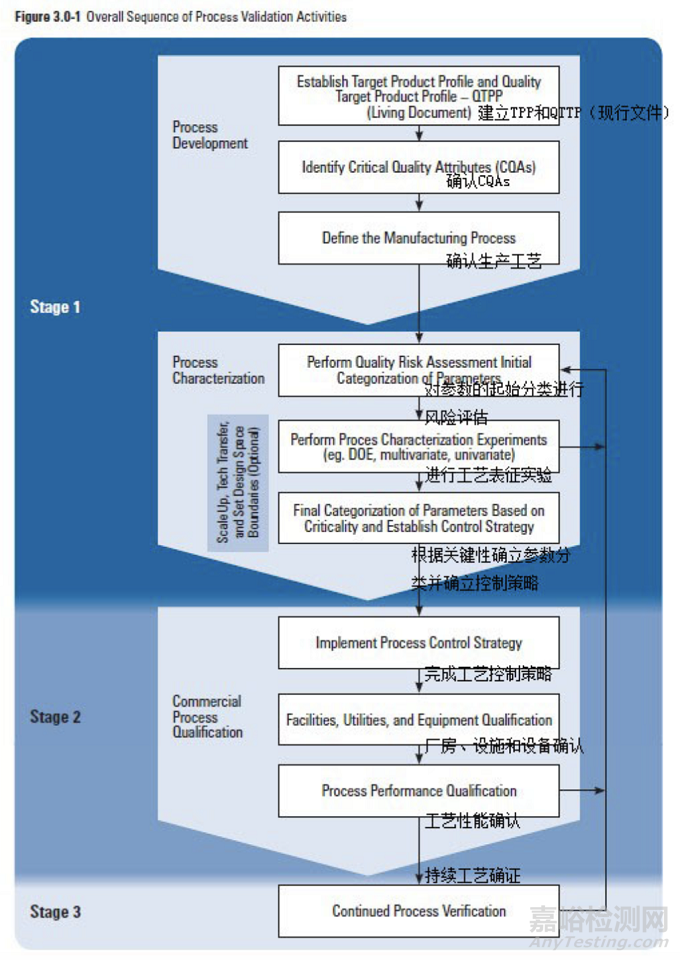
3.1 第一阶段工艺验证应达到的目标
下面的列表概括了在工艺验证生命周期中从第一阶段(工艺设计)到第二阶段(性能确认)转移所需的信息。本节详细讨论应转移的资料并提供额外的参考信息。
目标产品质量概况(QTPP)-第一阶段开始就完成的。
关键质量属性及对应的关键性风险评估和理想的置信程度
• 生产工艺设计
• 工艺描述:包括每个操作单元的工艺输入、输出、收率、中间检测与控制和工艺参数(设定控制点和范围);
• 工艺溶液处方、原材料及规格;
• 批记录和来自实验室或中试生产规模的生产数据
• 分析方法(包括产品、中间产品和原材料)
• 质量风险评估
• 工艺特性化前对参数进行基于风险的初步分类
• 关键性和风险评估
• 基于关键性和风险分析识别工艺参数
• 工艺特性化
• 工艺特性化计划和方案
• 研究数据报告;
• 工艺控制策略
• 放行标准;
• 中间产品控制与限度;
• 工艺参数设定点和范围;
• 日常监控要求(包括中间品取样和测试);
• 中间产品、加工溶液的贮藏和工艺步骤的时间限度;
• 原材料/成分规格;
• 设计空间(如适用)
• 过程分析技术应用和算法(如果使用 PAT)
• 产品特性化试验计划(即不包括产品放行检验中的试验)
• 生产技术-按工艺要求评价生产设备能力和适应性(也可以在第二阶段 2a 中进行)放大/缩小方法(实验室模型评价/确认)
• 药品开发文件
工艺设计报告
• 工艺验证主计划
3.2 目标产品质量概况(QTPP)
药物开发的目的是设计一种在制造过程中始终达到药品预期性能的高质量的产品。药物开发始于确定预先定义的目标。在目标产品质量概况(QTPP)中应有描述。QTPP 始于第一阶段开始并在整个产品生命周期中被参考引用。
QTPP 记录了全部药品相关的质量要求。而且,还要定期更新在药品开发过程中产生的新的数据。
但是,QTPP 不应偏离药品目标产品概况(TPP)所建立的核心目标。
注:作为工具的目标产品概况(TPP)有助于申请人-监管者的相互影响与交流。因此,TPP 包括诸如
药物适应症与用处、剂量与用法、剂型与规格、禁忌、警告与注意事项、不良反应、药物相互作用、
滥用和依赖性、和过量等不在本文范围内的信息。
目标产品概况包含的相关特性有:
临床预定用处(例如:剂型与规格、服用方法、传递系统、容器与密闭系统)。
原料药质量属性:适用于开发的药品剂型(如物理的、化学的、和生物学的性质)。
药品质量属性:适用于预期上市产品(例如:纯度/杂质、稳定性、无菌性、物理和化学性质)。
•治疗部分的释放或传递,以及适用于药品的影响药代动力学特性的属性(例如溶解、空气动力学行为)。
辅料和成分质量属性、药物-辅料相容性、和药物-容器相容性:影响药品的工艺能力、稳定性或生物学作用
QTPP 总结了药品的质量属性,保证药品的安全性和有效性。 QTPP 为产品质量属性关键性评估提供了一个起始点。
3.3 关键质量属性
关键质量属性(CQA)是指保证预期药品质量的物理、化学、生物学或微生物性质或特性在适宜的限度、范围或分布范围内。CQAs 可以与原料药、成品、辅料、中间产品(中间原材料)和容器/密闭系统有关。在工艺开发的早期可以限定对产品属性有效的信息。为此,起初设定的关键质量属性可能来自早期开发和/或类似产品而不是大量的产品性质。
质量属性的关键程度来源于利用基于风险的工具和质量属性对安全性与有效性的潜在影响。在对科学证据和风险进行了综合评估之后,根据关键性程度对质量属性排序,这样可能更能反映结构-功能关系的复杂性和属性分类不确定性的变化程度。与 CQAs 无关的属性在工艺开发中也应加以考虑。
CQAs 与标准规格是不同义的。另外,也没有必要将 CQAs 与标准规格一一对应。标准规格是检查试验的一个列表,是分析过程的依据,是待检品可接受标准的数字限度、范围或其他标准。被确定为 CQAs 的几个产品属性可以用单一方法检查,因此,可以建立单一的测试标准(例如:API 的溶解度、硬度、孔隙度是可以用一个试验-溶出度来评价的 CQAs)。有些在工艺过程中容易控制和达到的 CQAs 可以不包含在标准规格中(如病毒清除不是每批检查),而一些不是关键性的属性也可能制定在标准规格中。
潜在 CQAs 的确定是一个始于产品开发早期的持续性活动。它需要利用产品及其应用以及临床和非临床数据等一般知识。在产品开发的初期,CQAs 是易变的,所以需要质量风险管理方法以发展产生产品和工艺的知识(有关讨论见 6.1 节“风险管理的应用”)。商业产品的关键质量属性应在第二阶段活动开始前被定义。
3.4 定义制造过程
制造过程应设计成可以持续提供满足所需质量属性的产品。因为制造过程是在开发过程中定义的,
所以,过程描述就是用于帮助风险评估的实施和控制策略开发的工具。制造过程由一系列单元操作组成,工艺描述、方块图、工艺流程图描述每个单元操作。制造过程中的每个单元操作应用相似的详细程度进行描述。每个工艺描述应包含如下信息:
• 工艺需求,包括原材料、规模和操作指令;
• 工艺参数设定点和范围;
• 鉴定和定量所有材料流(附加物、废料、产品线);
• 测试、取样和中间控制
• 产品和附加溶液的保持时间和保持条件;
• 估计分步产量和持续时间;
• 仪器选型,包括色谱柱和过滤单元;
•制造商(如过滤器)和产品组分(如玻璃瓶、瓶塞)的特殊鉴定(如制造商、零件号码);
• 成功再现工艺所必须的其他信息。
图 3.3-1 描述了一个单元操作的工艺图实例,并在表 3.4-1 提供了一个工艺描述简表。工艺知识及理解的发展反映在临床批记录中。这些都是在工艺描述中定义制作过程的重要信息源。从临床试验材料制造收集的数据可能有助于确定过程能力、设定标准、设计 PPQ 方案和可接受标准、评价实验室模型和转移工艺。知识管理的策略和原则将在第 6.5 节“知识管理”中进一步讨论。
工艺描述是以报告的形式归档并可能编入产品技术转移(TT)文件包。由于材料要求的增加(如工艺和分析开发、临床需要),第一阶段工艺可能会改变,增进产品了解导致 CQAs 改变,工艺的进一步了解导致单元操作的增加、删除或调整。这些变化和支持性的说明应文件记录下来。这些信息应保存在知识管理系统中。
开发报告中商业制造过程的开发和归档应先于正式的工艺特性研究。在工艺特性化过程中获得的知识增加可能会要求增加工艺描述的变更。工艺的所有变更应按质量系统定义的变更控制程序获得批准。
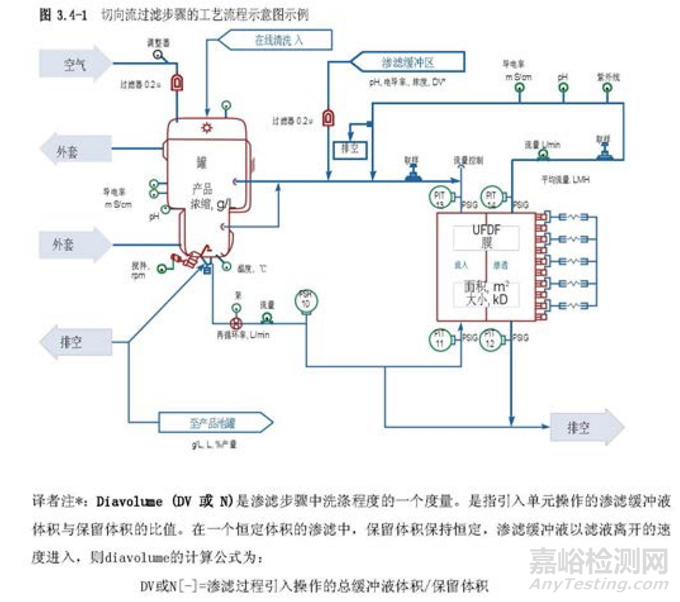
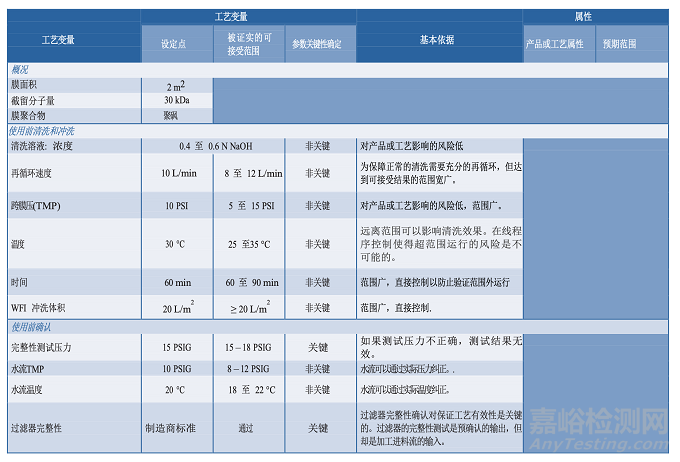
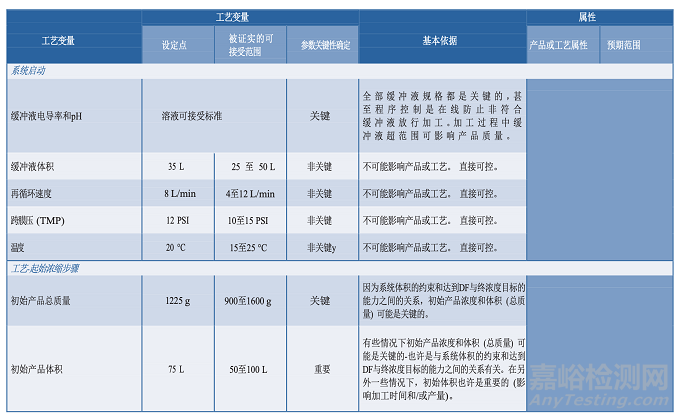
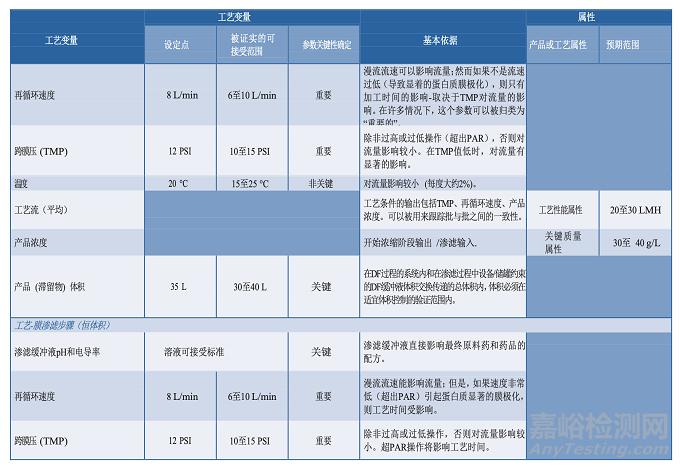
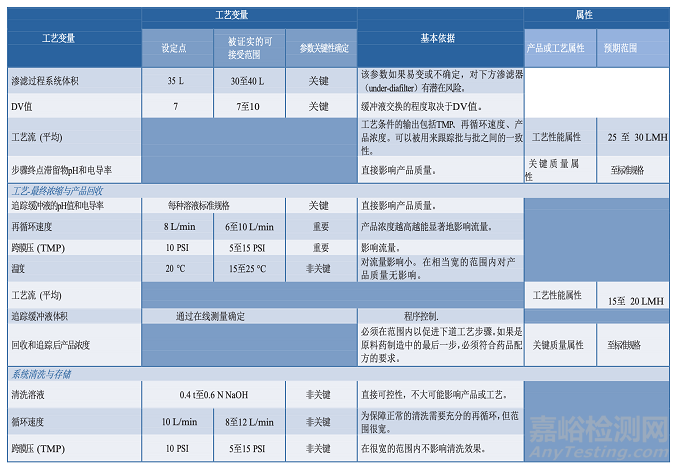
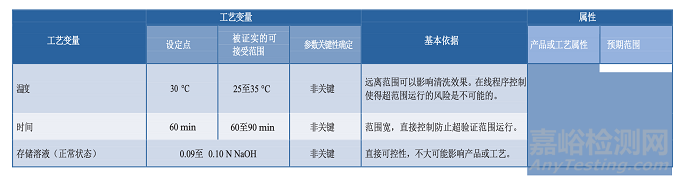
3.5分析方法
原材料、中间样品、原料药、药品成品的分析是控制策略(第3.8节)和工艺性质研究的主要方面。
用于这类研究的分析方法应该适用于其预定的用途,科学合理,可靠性、重现性好。应颁布开发过程中使用的分析方法的确认/验证策略,并提供在生命周期该阶段测试的评价方法(27)。关于分析方法评估的指南在FDA工艺验证指南中有论述(3)。工艺性质研究中使用的分析方法信息应包含在工艺特性化计划中,并记录在研究报告中。方法确认也应该记录在案,因为工艺性质研究可能在开发实验室进行,仪器必须做适当的校准和维护。
3.6 风险评估和参数关键性设定
风险评估在商业控制策略开发中具有重要作用。风险评估是在生命周期第一阶段的几个点上由跨学科团队实施的,分属于不同目标。(见第6.1节风险管理的应用)风险评估工具提供了一个结构化的方式记录与风险评估的结果相关的数据和理由,并成为工艺开发历史记录的一部分。
如图3.0-1所示,在第一阶段通过质量风险评估初步识别关键质量属性。初始质量风险评估是识别对产品质量或工艺性能影响最大的工艺输入参数变量的原因和影响分类。这个评估主要是基于已有知识或早期开发工作,评估结果为下述工艺性能研究提供基础。
了解工艺参数变化的影响和应用适当的控制是商业控制策略开发的基本要素。 ICH Q8 (R2)定义关键工艺参数(CPP)为:“对CQA有影响的可变参数,因此,应该被监测或控制以保证该工艺产生预期的质量”(3)。
根据对工艺的影响,工艺参数可以被进一步分类。在某些情况下,工艺性能的控制和监控是作为一个额外的控制手段,确保控制状态的协调一致。试验显示对工艺性能有影响的工艺参数可以分类为重要工艺参数(KPP)。 KPPs可以影响工艺性能属性(如在细胞培养过程中的抗体滴度或下游纯化产量),但不影响产品关键质量属性(15)。在有些工艺中,KPPs的识别和适当控制是有用的,因为工艺性能评估可能是批内一致性证明的一个重要手段。然而,除了普遍认可的定义ICH Q8(R2)的关键工艺参数,工艺参数命名会不规范、方法可能会有所不同。出于这个原因,在组织内参数命名的定义必须清楚地记录并理解。在整个工艺验证生命周期中参数命名的定义应保持一致。
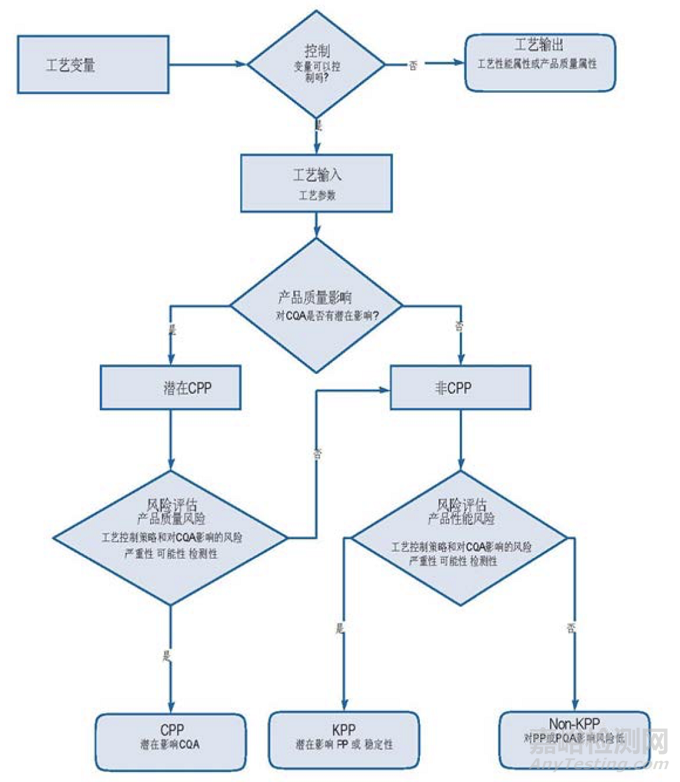
图3.6-1提供了一个决策树示例,以指导结合质量风险评估进行参数命名。决策树有助于将工艺参数分类为关键、重要或非重要(见定义)。决策制定工具可以帮助参与者形成共识,并有利于提高决策过程的一致性,以及作为风险评估过程部分有理由一致的记录文档。
决策树可以用于来源于工艺性能研究的支持数据前后的风险评估。
• 参数或属性:工艺变量可以是单元操作的输出和对另一单元的输入。对一个指定的单元操作,根据每个变量的直接可控性初步设定为参数或属性。
是—直接可控的工艺输入参数理论上有助于工艺的可变性。
否—不能直接控制的工艺输出是被监测的属性,可能表示工艺性能或产品质量。
工艺参数:对关键质量属性的潜在影响。
是—如果怀疑参数的变化对CQA有影响,或如果数据显示可能会有影响,则指定这个参数为关键工艺参数(CPP)。
否—参数为非关键工艺参数并进一步评价。
• 非关键工艺参数:如果超定义范围运行,潜在影响工艺性能或稳定性。
是—参数指定为重要工艺参数(KPP)。
否—在较宽的范围参数对工艺无影响。参数被指定为非重要工艺参数(non-KPP)。
Figure 3.6-1 关键性命名决策树
3.7 工艺特征描述
工艺特性描述是一套文档证明的研究,在该研究中操作参数被故意改变以确定它们对产品质量属性和工艺性能的影响。该方法使用来自于风险评估的知识和信息以确定一套工艺特性研究以检验提议的范围和对工艺参数的交互,结果/产生的信息被用于确定PPQ(工艺性能确认)范围和接受标准,它也能用于设置最终参数范围以及能被用于发展一个设计空间(如果用一个加强方法an enhanced approach),例如包括先进的分析的和/或生产控制技术到工艺开发中。能设计实验以检查拟议的范围以及探索一比将用于正常运行更宽的范围。
工艺特性的一个要素可能包括多变量设计实验以明确工艺设计空间,而单变量的方法对一些变化去建立一个证实的接受范围是合适的,多变量研究对工艺参数/物料属性间的交互作出了说明/解释。由于旨在特征化工艺和为工艺参数设置可接受范围的研究通常在实验室规模执行,因而实验室规模研究预测工艺性能的能力是合适令人满意的,当一个实验室规模的模型被用在研发中时,该模型的充分性应该被证实和合理说明。当在实际和期望的性能间有差异时,实验室模型和模型预测法应该适当纠正,因为从研究中得到的结论被直接应用到商业规模工艺。实验室模型的确认是必不可少的,缩小比例的模型的确认应该证实它们的性能代表实际的生产规模工艺,这通过比较运行参数和输入输出,包括产品质量属性。对用于蛋白产品的色谱层析步骤的缩小比例的模型能通过在设置点输入参数执行多次运行以及比较与实际规模的单元操作间的结果来确认。
评价的参数应该包括那些影响工艺一致性,诸如工序收率、洗脱图、洗脱体积和/或保留时间,然后这些应该与那些代表产品质量诸如可怜的纯度和工艺有关的水平以及与宿主细胞有关的杂质结合起来。代表商业生产工艺的小分子中试规模模型可能被用于支持PPQ数据,在固体和液体口服剂型,商业批量的10%和/或100000单位曾被考虑为一个代表性规模。某个工艺的放大的效果,诸如混合易溶解物质、药片压缩、或液体灌装可能众所周知。在原液10%的批量或运行100000剂量单位的倍数提供一个充分持续时间以确定控制程度和工艺特征,而未覆盖任何初步的主要问题。当小规模研究被用于支持PPQ时,实际规模确认/评估可能被执行。对于缩小比例研究,其原料、组件属性、设备以及工艺参数应该是具可比性和能表明预期用于商业产品的工艺。
3.8 产品特征测试计划
一些产品特性可能作为日常放行测试标准的一部分而不必测试,此类产品特性例子包括生物技术产品的残留DNA水平(当DNA清除率已经建立在一个能清晰超出安全要求的水平时)或固体口服制剂的最终产品的多孔性(当执行溶解度测试时),除了放行标准,阶段1可交付的成果应该包括其它对DS、DP或关键的中间体的测试为了说明对产品和工艺的全面理解。
3.9 控制策略
建立一个有效和适当的工艺控制策略是阶段1中药物研发最重要产出之一。一个恰当的控制策略是基于在阶段1中获得的知识和经验,它的效力关系到生产工艺保持受控状态的程度。正如上面讨论的阶段1的另一个方面,一个有效的工艺控制策略的开发时一个迭代过程(自我循环过程),它开始在研发早起以及成为工艺和产品知识增加。一个具耐受性的控制策略包含工艺中单个单元操作的所有元素,所有产品质量属性和工艺参数,不管它们是否被归类为关键,都将包括在一个完整的工艺控制策略中,完整的工艺控制策略包括下列元素:
原料控制
确保始终如一的输出的管理输入(原料和组件)质量的能力是工艺控制策略必不可少的,输入应该基于它们引入变化或污染到产品和/或工艺中的潜在风险而进行分类。产品变化性可能包括CQAs的改变,反之工艺变化性可能包括收率不一致、反应动力学、过滤性或其它非产品质量相关影响。对于生产工艺中所用的许多原料,选择适当级别(基于纯度、化学和物理特性、和/或微生物标准例如内毒素)可能是一个充足的控制水平;对于高风险原料,理解其对产品和工艺变化性的促成程度对建立那些物料的标准是必不可少的,一旦这关系被理解,适当的风险压缩步骤能采用成为控制策略的部分(见6.1.4节)。
过程和放行标准
过程和产品标准可能与产品安全性和有效性相关或可能保证产品一致性,确认不符合产品标准(过程或产品)取消临床或商业使用物料资格。关于设置标准的指南在ICH指南文件Q6a和Q6b中提供。
过程控制
过程控制是工艺的输入以及在在生产过程中执行检查以监控和调整工艺(如果适当),和/或确保中间体或产品符合标准或其它规定质量标准。
性能参数
性能参数(例如:片剂/胶囊崩解、 收获期或生长高峰期的细胞密度/活力)是工艺输出,不能直接控制单它反映工艺是否按预期。
工艺参数设置点和设置范围
工艺参数可变性对每个单元操作的输出和最终产品的影响的知识在工艺发展和工艺特征化过程中演变(3.7节),这信息连同工艺设备能力(4.1节)被用于建立参数设置点和范围(包括警戒限和行动限范围),也可用于评估由参数漂移所致的工艺偏差的严重性。参数范围可能被指定为正常操作范围(NORs),或当有支持数据证实时作为已证实的可接受范围(PARs)。
工艺监控(数据审核、取样、测试)
工艺监控包括测量数据(例如流速、温度、体积、pH)、过程取样计划、以及适当分析检测。数据收集和分析在阶段1开始以及是阶段2不可缺少的部分。数据收集工作最终发展成为阶段3中描述的持续工艺监控程序(见5.0节)
加工和保留时间
对所有工艺中间体(或过程物料)、药物成分、原液药物产品以及准备的溶液的保留条件和时间是工艺控制策略一个不可或缺的部分,应执行研究以支持这些限度,对工艺步骤的时间限度也应该是控制策略的一部分。
过程分析技术(PAT)
过程分析技术(PAT)是执行控制策略的一个方法,使用PAT,CQAs被实时监控(用在线分析),在生产过程中其结果用于调节CPPs以减少产品变化(CQAs)或得到在期望范围内的变化性小的已知的CQAs。
PAT使用产品和工艺知识以及设备自动化和分析仪表技术,成功的PAT应用要求一个彻底的特征化工艺(3.7节),在该特征化工艺中,CPPs和CQAs间关系用数学模型探索,诸如多变量分析。对控制策略的理解的应用也影响生产工艺中测控系统的确认。为支持PAT的执行,阶段1交付必须描述CQA监控计划和基于工艺响应调节CPPs的算法。设备、 测量系统以及工艺的确认(阶段2)必须证明安装建立的运算法则调整CPPs的能力以及确认这些调整导致的可接受的和预测的输出。因而,基于控制方法的PAT需要被确认。
3.10临床生产经验-批记录和生产数据
在阶段1过程中,临床批被用于临床试验中以支持产品批准,这数据可能连同正式的工艺特征数据一起被用于支持生产工艺参数和工艺控制策略的建立,这些数据也包含PPQ之后将继续的工艺监控的起始数据。早期的批数据可能不包括所有在最终商业工艺中执行的控制,但这信息对评估工艺性能仍然有价值。如果用于支持范围和限度,临床批数据应该包括在最终工艺设计报告中用于证明工艺和控制策略。最终批记录应该在阶段1结束时产生,它们将支持最终的商业工艺和充当阶段2的前奏。
在一些情况下,用来自于临床批的数据支持PPQ阶段2可能是适当的,这个方法的原理应该被记录且包括在工艺验证主计划中。
3.11工艺设计报告
工艺设计报告也是阶段1的输出,作为一份详细描述预期的商业工艺的动态文件,它可能在内部程序里有各种各样的主题名称。阶段1研究数据被用于支持这个文件以及证明范围和工艺控制策略。生产工艺变更时收集到的额外的数据和工艺知识收集起来病囊括在阶段2和3中工艺设计报告应该被更新以包括这信息的更新,这全面的文件包括:
• 参考CQAs和支持风险评估
• 工艺流程图
• 工艺描述表
• 输入(过程控制)
• 输出(过程测试和限度,过程标准)
• 工艺参数和范围;
• 对CQAs和工艺性能有影响风险的参数分类
• 设计空间,视情况而定;
• 支持所有参数范围的合理说明和数据(例如,特征数据、开发研究、临床生产历史);
3.12工艺验证主计划
一个工艺验证主计划可能在阶段1到准备阶段2活动期间被发起,它应该描绘概述验证策略和支持原理,通常包括:
• 工艺特征计划;
• 生产工艺和控制策略的描述;
• 部门与责任;
• PQ和PPQ计划
PPQ策略(例如单个单元操作或单元操作的合并、bracketing、家族法或矩阵法)和单个草案、可适
用的辅助研究清单(例如混合培养基准备、过程持续时间、树脂生命周期);
所用的设备和设施清单;
• 分析方法和它们状态清单;
• 取样方法;
• 在计划下将被执行的草案列表;
• 建议的时间表和交付计划;
•处理偏差和再版的程序;
• 持续工艺确证计划;
3.13 阶段 生产和技术考虑
生产设备的能力和程序对维护工艺参数在预设定限度里的能力有关键影响,工艺设备的测量和控制是阶段2科目之一,工艺确认,4.1部分有介绍。设备确认活动应该确认设备对预期用途的适宜性。
工艺物料流与设备和他们接触的材料(例如聚合膜、橡胶、免洗袋和其它塑料部分)的相容性要能保证产品的安全和有效。产品接触材料和溶出物、萃取物需要评价他们的相容性。这个工作在第一阶段开始,可能包括一些需要长的前置时间的研究,并且应该结合阶段二来完成。
工艺物料流与设备表面的相容性是对在生产接触时他们的反应、吸收和稳定性的衡量。相容性测试是为了证明设备表面的材料性质不会因接触溶液或其它产品相关物料而改变。另外,接触材料也不应该改变工艺溶液或物料(通过吸附产品组分或者过量吸出而掺混产品)萃取物是一种材料的成分(例如用于药品生产或储存的产品接触表面),通过使用一种夸大的外力(溶剂、时间、温度)而得到。浸出物是来自工艺设备或存储容器的接触材料的成分,它们在正常使用状态下转移到产品中。
来自于用于药品生产、储存、包装得聚合膜盒的组件(塑料存储器、滤器、内包装材料、垫片、O形圈)的浸出物的种类和数量必须通过文件列明以此保证产品不会被掺入杂质。要结合文献查阅、
风险评估和实验室研究来说明浸出物。各种确定测试的程度和浸出物种类的鉴别。还有可接受水平的设定的方法都已经出版。
“口服吸入和鼻喷药物的萃取物和浸出物的安全阈值和良好实践”
“产品接触表面的萃取物的评价”
“使用 QbD对萃取物 /浸出物评估的原则:为储存在塑料包装系统的最终灭菌的液体药物确立设计空间”
“原料药的浸出物的评价”

来源:文亮频道


