此文提供了为医疗器械选择适当无菌保证水平(SAL)的信息。无菌保证水平(SAL)仅适用于最终灭菌工艺(例如湿热、环氧乙烷、辐射灭菌、汽化过氧化氢)。这一选择涉及许多因素,但由于SAL的选择与灭菌剂量直接相关,因此这一决定对于任何产品的无菌声明都至关重要,必须考虑对产品设计的影响(材料选择、客户需求和愿望、功能等)。
无菌医疗器械是指没有活微生物的器械。然而,该定义通常包括一个注释,说明在实践中,无法证明不存在微生物的绝对陈述。
对于无菌医疗器械,这可以通过以下方式实现:
• 最终灭菌过程(TS): TS是在无菌屏障系统中对产品进行微生物控制的非无菌制造和密封,并应用可重复的、经过确认的灭菌工艺,以对数方式将微生物载量降低至指定水平。
• 对组件进行灭菌,然后进行无菌过滤并无菌灌装到无菌容器中(AP)。
• 化学/物理灭菌和无菌工艺的结合。
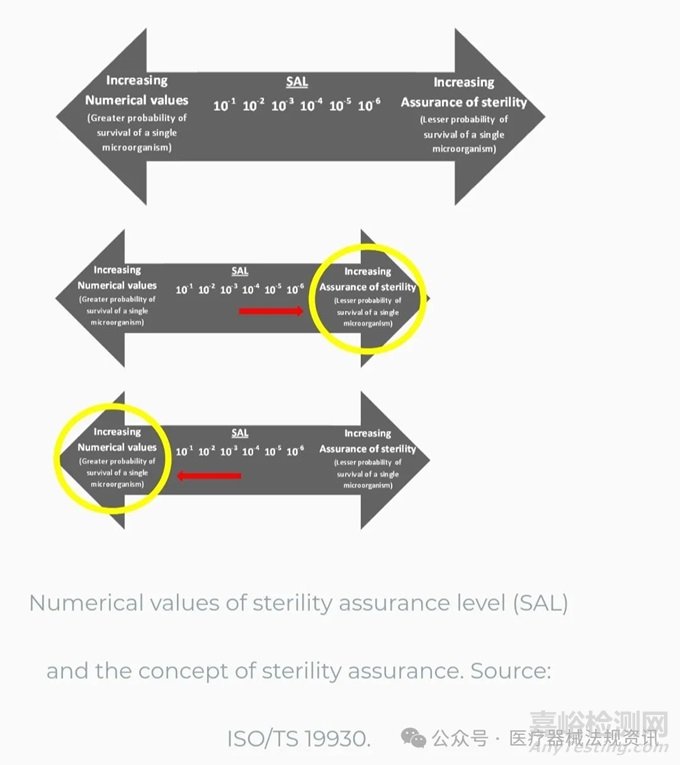
任何产品的无菌性都是由灭菌后产品上存活微生物的概率来定义的。这种概率被称为无菌保证水平(SAL)。SAL通常表示为10-n,历史上,10-3或10-6值最常用于灭菌。SAL表达10-n是确保无菌性的定量值。当应用这个定量值时,SAL越低,无菌性越有保证。例如,10-6 SAL比10-3 SAL低,因此提供了更大的无菌保证。虽然这种可能性永远不会降低到零(100%保证水平)并且仍然有产品可供使用,但它可以并且有望降低到非常低的数字。
三份文件直接涉及无菌保证/SAL。
第一个是EN 556-1。本标准于1994年首次发布,当前版本(正在修订中)为EN 556-1:2006《医疗器械灭菌—标明“无菌”医疗器械的要求—第1部分:最终灭菌医疗器械的要求》。它将“无菌”指定为10-6 SAL,但确实包含一条注释,说明经监管机构批准后可以使用其他SAL。
第二个涉及无菌保证的文件是ANSI/AAMI ST67,该文件自2003年以来一直处于标准领域。该标准的当前版本为ANSI/AAMI ST67:2019,卫生保健产品的灭菌——为标有“无菌”标签的产品选择无菌保证水平(SAL)的要求和指南,它当然包括10-6 SAL,但也规定“无菌”可以包括其他SAL(例如10-3、10-4、10-5),并提供了替代SAL的指导和示例。
第三份文件是ISO/TS 19930,关于确保最终灭菌的一次性卫生保健产品无菌性的基于风险的方法方面的指南,包括无法承受最高达到10-6无菌保证水平的产品。本技术规范的目的是在无法使用10–6时为备用SAL提供指导。
10-6的SAL经常用于医疗器械的最终灭菌(发现未灭菌单位的概率为1/1000,000)。10-3的SAL也已经用于一些医疗器械,这取决于它们的预期用途或它们承受提供10-6 SAL的最终灭菌过程的能力。灭菌工艺和SAL的选择应在符合质量体系的产品开发和工艺设计要求的早期解决。选择适当的确认方法,以证明灭菌过程将常规提供所选的SAL(例如,用于辐照的ANSI/AAMI/ISO 11137:2006)。随着时间的推移,通过剂量审核过程来证实这一无菌声明。
为什么通常期望医疗器械达到10–6?
鉴于无菌处理基本上提供了相当于10-3或10-4的非无菌单位概率(PNSU),为什么要求或期望最终灭菌应提供10-6的SAL?
有观点认为,就患者感染的机会而言,10-6更“安全”。然而,SAL在实践中并不意味着更高的安全性。根据Srun等人的研究,可以清楚地证明SAL为10–4、10–5和10–6的器械在手术部位感染(SSI)的可能性方面没有差异。
Srun等人的报告是基于疾病控制和预防中心关于SSIs的信息。考虑到手术过程的所有方面以及可能导致感染的多种因素,可以计算出改变SAL对SSI总体概率的影响概率。最终证明,10–4、10–5或10–6的SSI概率没有变化。即使SAL从10–6变为10–3,SSI概率的变化也不到0.04%。
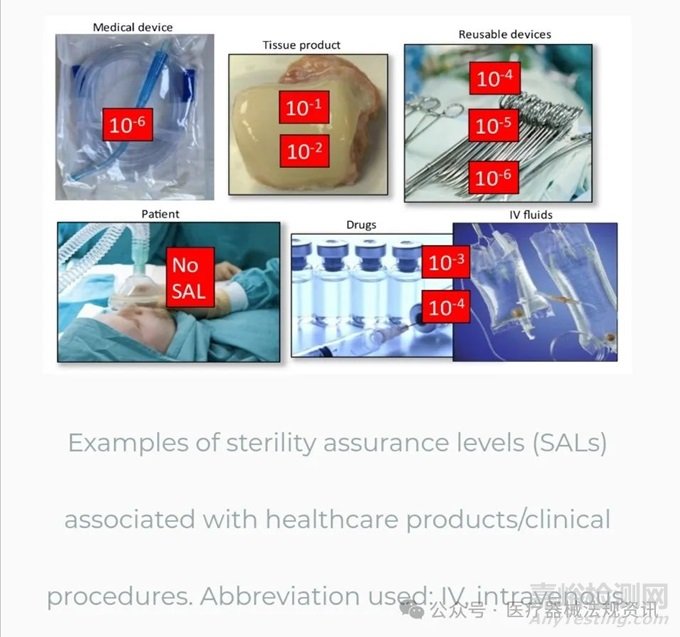
SAL讨论的另一个方面是在外科手术中发现的SAL/PNSU的多样性。考虑到外科手术中使用的许多产品,SAL/PNSU可能在10–1到10–6之间。下图显示了一些医疗保健产品及其相应的SAL。对于不能最终灭菌的纸巾产品,无菌保证只能通过擦拭后进行无菌测试来证明。静脉注射液体和药物经验证可提供相当于10-3或10-4 PNSU的量。
可重复使用的器械可以通过多种方式进行处理,从蒸汽到液体化学灭菌,并且必须依靠充分的清洁来保证灭菌过程的有效性。此外,患者和临床医生也会在手术过程中造成污染。然而,医疗设备的SAL期望为10–6 SAL。这是为什么呢?
实际上,一打开产品包装,10–6 SAL并不能比临床使用的所有其他产品提供更高程度的无菌保证。临床环境中的各种操作、人员和实践增加了感染的风险。此外,许多医疗保健产品,尤其是无菌加工的产品,其PNSUs低于10-6。因此,最终灭菌产品的备用SAL(如10-4、10-5)不会增加患者安全风险。
尽管如此,很明显,当无法实现10-6的SAL时,使用TS和替代SAL(例如10-4)确实是与AP平等的选择。
对于所有医疗器械的灭菌,应根据产品经过灭菌过程后的功能选择和使用最严格的SAL。如果产品不能承受10-6 SAL,则在选择10-3 SAL之前应调查10-5和10-4 SAL。在继续操作之前,还必须确定是否符合特定器械的监管要求。AAMI ST67给出了以下选择标准。
10-6 SAL,或提供更高无菌保证的SAL(即10-6、10-7等))用于:
• 接触破损皮肤或受损组织的产品
• 进入正常无菌组织的侵入性产品
• 宣称无菌液体通道的产品
• 外科植入器械
10-3 SAL,或提供更高无菌保证的SAL(即10-4、10-5等))用于:
• 不打算接触破损皮肤或受损组织的产品
• 接触完整皮肤或粘膜的局部产品
当产品需要10-6,但无法承受灭菌过程时,可能有必要选择10-6以外的SAL。当满足以下所有条件时,可以应用不同的SAL:
• 该产品的设计无法在不影响其功能和安全性的情况下实现SAL为10-6的灭菌过程
• 该产品为患者诊断、治疗或护理提供独特或卓越的优势
• 没有替代产品可以用达到10-6 SAL的工艺进行灭菌