引言
本文带大家通过查询药典、法规及参比制剂资料等信息,确定原辅料、包材及制剂标准,形成目标产品质量概况(QTPP)。
1、原料药标准
1.1查询方式一
根据《注射剂项目研发生产策略全解析》中(第一篇处方前研究)查询的原料药相关信息,购买他们的物料小样(多厂家购买,数量够原辅料相容即可),如可能,索要原料供应商资料,作为参考。
1.2查询方式二
查询参比制剂上市国、主流国家(美、欧、日)及中国药典,药物在线标准数据库(功能强大,强烈推荐)。
1.3资料分析
查询到的资料需要参考ICH、国内等各类法规,最终确定不低于中国药典且制备的制剂不次于参比制剂的标准。
1.4资料汇总
1.4.1常规检查项
对比中国药典标准(若收录)、国内各厂家标准、主流国家药典标准(美、欧、日)及参比制剂研发上市国药典标准(该标准与参比制剂所用标准可能一致),同时依据ICH、国内等各类最新法规,确定原料药重点关注内容,和选用的原料药厂家提前交流进行限度控制,减少后续不确定性。
常规检查项目:
(1)性状
外观、溶解度及比旋度
重点关注:
颜色,若制剂的制备工艺无改变成品颜色的功能(使用活性炭吸附已不被认可),则选用不低于参比制剂颜色的原料药;
外观形态,与不同晶型可能有关,直接影响溶解度,尽可能选择与参比制剂研发上市国药典标准一致的原料药,若不一致,则需要检测其晶型和溶解度;
溶解性能,与原料药构型有关,尽可能选择与参比制剂研发上市国药典标准一致的原料药;
比旋度,对同一物质是一个常数,尽可选择与参比制剂研发上市国药典标准一致的原料药;
(2)鉴别
紫外及红外
重点关注:
鉴别,目的是依据药物的组成、结构与性质通过化学反应、仪器分析或测定物理常数(结合性状项下的外观和物理常数)来判断药物的真伪,确定为同一物质即可,不用过分关注。
(3)检查
酸碱度、有关物质、干燥失重及重金属
重点关注:
酸碱度,需要特别关注,特别是正常生产多批投料时,原料药酸碱度不同时需要不同量pH调节剂进行调节;
有关物质,有关物质主要是在生产过程中带入的起始原料、中间体、聚合体、副反应产物,以及贮藏过程中的降解产物等,结合Q3A(R2):新原料药中的杂质及Q3B(R2):新药制剂中的杂质等标准,需要特别关注原料药的杂质谱及限度指标,不次于参比制剂;
干燥失重,指待测物品在规定的条件下,经干燥至恒重后所减少的重量,注意多批次干燥失重的数据,干燥失重数据偏差过大会影响原料药的稳定性;
重金属,指在规定实验条件下能与硫代乙酰胺或硫化钠作用显色的金属杂质,特别关注制剂成分中是否与金属杂质进行螯合或其他反应,若有,重点控制其限度;
(4)含量
重点关注:
含量,物质中所包含的某种成分的量,特别关注原料药中带有结合水、盐基等成分,注意投料准确性及多批次含量数据;
(5)类别
重点关注:
类别,原料药分类涉及制剂药品分类,结合ATC分类用于共线生产评估及确定生产线适用性;
(6)贮藏
重点关注:
贮藏,药品的稳定性不仅与其自身的性质有关,还与外界温、湿、气体及包装材料有关,特别关注自研制剂的贮藏方式不应严于参比制剂;
附加检查项目:
(1)残留溶剂
重点关注:
残留溶剂,指在原料药生产中使用的,但在工艺过程中未能完全去除的有机溶剂,在常规剂型制备工艺中很少有去除残留溶剂措施,结合Q3C(R8):杂质:残留溶剂的指导原则,控制原辅料残留溶剂不高于制剂标准;
(2)元素杂质
重点关注:
元素杂质,药品中的元素杂质有多种来源;它们可能是在合成中有意添加的催化剂的残留,也可能是实际存在的杂质(如:与生产设备或包装系统相互作用产生的杂质或药品各个组分中存在的杂质),结合元素杂质指导原则Q3D(R2),控制原辅包、生产设备及注射用水等多途径的元素杂质不高于制剂标准;
(3)细菌内毒素
重点关注:
细菌内毒素,是G-菌细胞壁的脂多糖成分,于细菌死亡解体后释放,适量时可激活免疫系统,对机体产生有益作用,过量则可引起机体严重的病理生理反应,表现为发热、低血压、心动过速、休克、多器官功能衰竭甚至死亡,控制原辅包、生产设备及注射用水等多途径的细菌内毒素不高于制剂标准;
(4)微生物限度
重点关注:
微生物限度,微生物包括:细菌、病毒、真菌以及一些小型的原生生物、显微藻类等在内的一大类生物群体,它个体微小,与人类关系密切。微生物限度检查法系检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。检查项目包括细菌数、霉菌数、酵母菌数及控制菌检查;关注非最终灭菌产品及最终灭菌产品的法规控制限度;
2、辅料标准
控制标准不低于药典相应标准。
3、附带溶剂和配件标准
附带溶剂和配件(若有),不低于参比制剂标准,注意其相容性及使用性。
4、包材标准
控制标准不低于国家药包字YBB标准,关注玻璃包材和塑料制品包材的相互替换,注意透水透氧率等不一致的指标。
5、制剂标准
查询药智数据库、各国药典,参考ICHQ3a、国内相关法规,对比分析,目的是查寻原研药、国内厂家(近期获批的)的制剂标准。
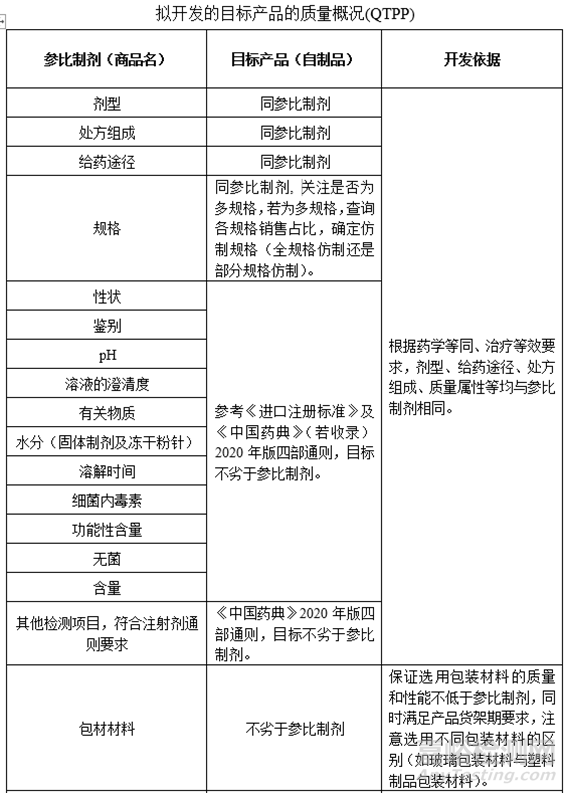
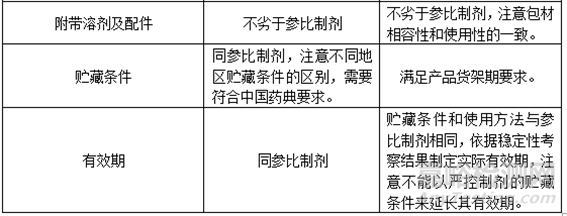
6、确定QTPP
7、总结
本篇《注射剂项目研发生产策略全解析》中(第三篇研发策略制定),通过查询药典、法规及参比制剂资料等信息,确定原辅料、包材及制剂标准,形成目标产品质量概况(QTPP),为后期制定实验计划提供相关依据。
8、资料收集途径
1、https://db.yaozh.com/(药智数据库,很全面,90%以上的资料都有)
2、https://xueshu.baidu.com/(百度学术,查制剂的文献资料等)
3、https://www.baidu.com/(百度,查上市历史、销售数据等)
4、https://www.drugfuture.com/pmda/(日本上市药品数据库,查处方、说明书等)
5、https://db.ouryao.com/(中国药典、法规及标准,查药品及检测标准等)
6、https://www.cde.org.cn/ (国家药品监督管理局药品审评中心,查原辅料上市信息及指导原则等)
7、https://www.canbigou.com/directory.html (参比购,查参比制剂目录)
8、https://www.drugfuture.com/fda/ (美国FDA药品数据库(U.S. FDA Drugs Database),查处方、说明书等)
9、https://www.drugfuture.com/ema/(欧盟EMA药品数据库,查处方、说明书等)
10、https://drugx.cn/ (药研导航,查各国药监局及药典等)