今日头条
远大抗感染创新药上脓毒症II期临床。远大医药旗下Grand Medical开发的小分子抗感染创新药STC3141用于治疗脓毒症的中国II期临床完成首例患者给药。STC3141通过中和胞外组蛋白和中性粒细胞诱捕网来逆转机体过度免疫反应造成的器官损伤,可用于包括脓毒症和急性呼吸窘迫综合征(ARDS)等多种重症适应症。在Ib期临床中,STC3141能剂量依赖性帮助ARDS患者脱离呼吸机、脱离升压药和缩短ICU住院时间,且耐受性良好。
国内药讯
1.石药SOS1抑制剂获批临床。石药集团1类化药SYH2038片获国家药监局临床试验默示许可,拟开发用于治疗晚期恶性肿瘤。SYH2038是一款高选择性SOS1抑制剂,通过抑制KRAS蛋白与SOS1蛋白相互作用,抑制肿瘤细胞的恶性进程。在临床前研究中,SYH2038已显示出对药效靶点选择性高,并具有良好的体内外活性和良好的安全性,有望为患者提供一种新的治疗选择。
2.复宏汉霖PD-L1靶向ADC获FDA临床许可。复星医药旗下复宏汉霖开发的靶向PD-L1的ADC药物注射用HLX43获FDA批准开展Ⅰ期临床,评估用于治疗晚期/转移性实体瘤的安全性与初步疗效。在临床前研究中,HLX43已在多种PD-L1+ CDX和PDX模型中显示出诱导肿瘤消退的潜力,且药物安全性良好。今年10月,该新药已在国内获得国家药监局临床批件。
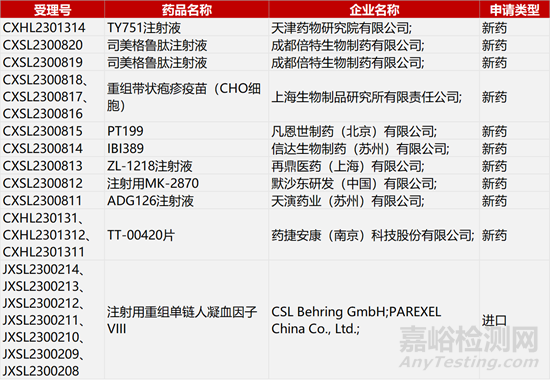
3.亘喜双靶点CAR-T获批自免病临床。亘喜生物靶向BCMA/CD19双靶点自体FasTCAR-T产品GC012F获FDA批准开展一项新的Ⅰ/Ⅱ期临床试验,评估GC012F用于治疗难治性系统性红斑狼疮(SLE)的安全性、耐受性、药代动力学特性以及初步疗效。今年2月,该新药已在美国获批针对复发/难治性多发性骨髓瘤(R/R MM)开展Ⅰb/Ⅱ期研究。在临床试验(IIT)中,GC012F在RRMM患者中的总体应答率(ORR)达到100%。
4.杭州壹瑞Kv1.3抑制剂获批皮炎临床。杭州壹瑞医药1类化药YR001软膏获国家药监局临床试验默示许可,拟用于特应性皮炎(AD)的皮肤局部治疗。YR001是一款高选择性钾离子通道Kv1.3小分子抑制剂,壹瑞医药计划将其开发为轻中度AD患者包括儿童和婴幼儿的一线治疗用药。在美国完成的Ⅰ期临床中,所有受试者中表现出良好的安全性及耐受性。
5.再鼎CCR8单抗国内报实体瘤IND。再鼎医药1类生物制品ZL-1218注射液临床试验申请获CDE受理,拟开发用于治疗实体瘤。ZL-1218是一款CCR8抗体,通过清除肿瘤内调节性T细胞发挥强效抗肿瘤作用。公布于AACR2022年会上的临床前数据显示,ZL-1218单药治疗以及与抗PD-1药物联合使用在动物模型中均具有积极的抗肿瘤活性。目前,该产品正在全球I期临床中评估实体瘤临床治疗的潜力。
6.凡恩世CD73单抗国内报IND。凡恩世制药自主研发的1类生物制品PT199的临床试验申请获CDE受理。PT199是一款新一代CD73单抗,旨在对抗腺苷介导的免疫抑制性肿瘤微环境,突破CD73抑制剂的局限性,有望增加抗肿瘤免疫活性,为癌症患者提供新的治疗选择。在美国开展的Ⅰ期临床数据显示,PT199具有良好的安全性、耐受性及PK/PD特征。
国际药讯
1.硬纤维瘤创新药获FDA批准上市。SpringWorks公司口服特异性γ-分泌酶小分子抑制剂Ogsiveo(nirogacestat)获FDA批准上市,成为首款获批针对硬纤维瘤的治疗药物,用于患者进行全身治疗。在Ⅲ期DeFi试验中,nirogacestat显著改善患者的无进展生存期,将患者疾病进展风险降低71%。此前,该新药已获得FDA授予快速通道资格、突破性疗法认定与优先审评资格,用以治疗硬纤维瘤或深部纤维瘤。
2.艾伯维CD3/CD20双抗向EMA报新NDA。艾伯维皮下注射CD3xCD20双抗epcoritamab的新适应症上市申请获欧洲药品管理局(EMA)受理,用于治疗至少接受过两种系统治疗的复发或难治性滤泡性淋巴瘤(R/R FL)患者。在I/II期EPCORETMNHL-1研究中,经独立审查委员会(IRC)评估的总体缓解率(ORR)达到82%。今年5月,epcoritamab(Epkinly)首次在美国获批上市,用于三线及以上治疗复发或难治性弥漫性大B细胞淋巴瘤。
3.葛兰素史克BCMA-ADC骨髓瘤Ⅲ期临床积极。葛兰素史克靶向BCMA的ADC药物belantamab mafodotin联合硼替佐米加地塞米松(BorDex)治疗复发或难治性多发性骨髓瘤的Ⅲ期临床DREAMM-7达到主要终点。与daratumumab与BorDex方案相比,belantamab mafodotin联合治疗显著延长患者无疾病进展或死亡的时间;患者总生存期(OS)也显示出显著改善趋势。药物的安全性与已知研究一致。详细中期分析结果将在科学会议上公布。
4.Arvinas公司AR靶向PROTAC上Ⅲ期临床。Arvinas公司宣布完成3.5亿美元的私募融资,用于推进其第二代AR靶向PROTAC降解剂ARV-766开展治疗转移性去势抵抗性前列腺癌(mCRPC)患者的Ⅲ期临床试验。公布于ESMO2023会议上的Ⅰ/Ⅱ期临床数据显示,在AR T878X/H878Y突变、AR LBD突变和AR L702H突变三队列中,ARV-110治疗达成PSA水平降低≥50%(PSA50)的比例分别为54%、36%和8%。
5.罕见皮肤病创新基因疗法获FDA优先审评。Abeona公司自体COL7A1基因校正表皮片基因疗法pz-cel(EB-101)获FDA授予优先审评资格,用于治疗隐性营养不良性大疱性表皮松解症(RDEB)。PDUFA日期为明年5月25日。在Ⅲ期研究中,与对照组相比,EB-101治疗组第6个月时伤口较基线愈合50%或以上的患者比例更高(81.4%vs16.3%,p<0.0001);伤口较基线平均疼痛分数降低更多(3.07分vs0.90分,p=0.0002)。
6.JAK1/TYK2抑制剂自免病II期临床失败。Priovant公司潜在“first-in-class”TYK2/JAK1双分子抑制剂brepocitinib治疗中重度活动性系统性红斑狼疮(SLE)II期研究未达主要终点。该公司计划终止brepocitinib用于SLE的临床开发。此外,Priovant预计在明年第一季度公布brepocitinib治疗非感染性葡萄膜炎II期POC研究结果,以及在2025年公布皮肌炎III期临床结果。Priovant是辉瑞与Roivant公司合作创建的新公司。
医药热点
1.2023全国医院互联网影响力指数发布。11月28日,国内知名互联网医疗平台「好大夫在线」发布2023全国医院互联网影响力指数。今年的指数共公布了互联网融入程度较高的36个专科331个科室,分布在20个省23个市的142家医院。从入围科室数量来看,北京协和医院、北京大学第三医院、北京大学第一医院、复旦大学附属中山医院、郑州大学第一附属医院居前五名;从指数上升情况来看,郑州大学第一附属医院、浙江大学医学院附属第一医院、广州市妇女儿童医疗中心分列前三;广西医科大学第一附属医院、武汉大学人民医院等10家医院首次入围。
2.深圳明年起实施专科护士处方权。深圳市人民政府办公厅发布文章《深圳在全国率先赋予专科护士处方权 明年起实施》,宣布深圳在全国率先以立法形式赋予专科护士处方权,2024年1月1日起实施。根据《办法》,专科护士要获得处方权,需经过理论培训和临床实践,还要通过深圳市卫生健康部门组织的终期考核。
3.河南形成覆盖全省的胸痛救治网络。近日,河南省胸痛联盟在郑州召开胸痛救治单元推进会议和胸痛救治单元培训启动会,加速胸痛救治网络全覆盖 ,进一步降低急性心肌梗塞死亡率。截至11月,河南全省二级以上医疗单位胸痛中心已经认证214家,数量和质量名列全国第一,实现了全省18个省辖市全覆盖,初步形成覆盖全省的胸痛救治网络。
评审动态
1. CDE新药受理情况(11月28日)
2. FDA新药获批情况(北美11月22日)