预测性稳定性研究允许从短期稳定性研究的结果外推,对原料药或药品的长期稳定性特性进行表征。这些研究通常持续一个月。最常用的预测稳定性研究类型是加速稳定性评估程序(ASAP)研究,该研究侧重于通过降解产物的形成或药物物质的损失来监测化学降解。ASAP包括设计实验、确定研究、存储和分析样品,然后进行数据审核和建模,最后进行稳定性预测。本文将在这几个方面向大家介绍。
一、ASAP简介
1.1 加速稳定性研究的必要性
在药品的开发和商业阶段对药品进行稳定性测试对整个行业而言,无论是在成本、资源还是时间上都会造成重大负担。预测性稳定性方法利用加速或压力条件下进行较短期的稳定性研究,并设计成可以将降解动力学外推回环境存储条件[1-5]。以这种方式,可以在通常持续一个月的短期研究中研究药品物质或药品的稳定性特性。通过预测性稳定性研究,不仅可以确定适宜的长期存储条件,还可以选择适当的包装,并预测复验期或货架期。
1.2 实验原理
ASAP基于标准的阿伦尼乌斯动力学方程(适用于溶液或液体),以及对固体的改进的阿伦尼乌斯方程,还考虑了湿度对反应速率的影响,如下所示。
其中:
k为反应速率
ln(A)为碰撞频率
Ea为活化能(kcal/mol)
R为气体常数(kcal/(K·mol)
T为温度(K)
B为湿度因子
RH为相对湿度(%)
ASAP研究的目的是在一系列温度湿度条件下,独立地变化温度和湿度,将样品降解至限度水平。这样可以确定在每个测试条件下达到规定限度所需的时间(或达到规定限度的反应速率)。为了求解相关的阿伦尼乌斯方程,需要确定特定反应的碰撞频率(ln(A))、活化能(Ea,以kcal/mol表示)和湿度因子(B)(如果相关的话)。然后可以利用这些值预测在任何给定条件下达到限度的反应速率,从而确定样品的存储条件和复验期/货架期。重要的是,样品在每个存储条件下都要被降解到相同程度(通常是标准中的限度),从而确保在整个研究中降解动力学保持类似,这个概念被称为等转化。这旨在克服非均质固体动力学的复杂性。
二、ASAP预测方向
2.1化学稳定性
ASAP研究可用于调查一系列药品材料的化学稳定性,包括原料药、起始物料、中间体、制剂(片剂、胶囊、颗粒、溶液、冻干物等)。迄今为止,制药行业进行的ASAP研究通常应用于小分子,但也可以应用于生物大分子,特别是在化学降解可能是货架期限制属性的情况下。
从ASAP研究中产生的数据反映了所用分析方法的质量。这些方法应具有稳定性指示能力。特别是对于由液相色谱法(LC)进行的有关物质方法,降解产物应与主成分适当分离。因此,建议进行一些强制降解研究,并使用降解样品来辅助方法开发。对于含手性中心的药品,还应在ASAP实验中囊括异构体杂质的监测。
ASAP研究的一个局限性是它们往往专注于化学降解,而这可能不是限制货架寿命的关键属性。在预测货架寿命时,还应考虑和调查其他稳定性指示属性,例如物理形态稳定性,口服固体剂型的溶解度或溶液制剂的沉淀、pH变化或微生物生长。
ASAP研究的一个重要前提是在研究过程中,被研究物质的实体不会改变物理形态。需要考虑的物理变化,包括晶态转变、水合或脱水、熔化、吸湿甚至升华等。建议在最后一个时间点检查存储在最严苛条件下的ASAP样品的物理形态,并与初始样品进行比较,以确保没有发生变化。通常,分析来自最高温度和湿度条件的样品,但还应考虑高温下的最低湿度,因为这种条件可能引发水合物的脱水。
任何形态变化都可能导致降解动力学的变化,使得对长期存储条件的预测失败。因此,在设计ASAP研究方案时,评估样品或样品组分在超过临界温度或湿度时可能改变形态,并相应地调整研究方案是很重要的。
2.2 包装系统预测
预测产品在货架期的包装内相对湿度和不同包装下降解程度。还可以预测患者使用情境下的包装湿度,这些预测考虑了瓶子的开启和关闭,例如每次取出一定数量的药片。通过这些预测,可以选择合适的包装形式和配置。例如,可以确定改变瓶中药片数量的影响,以及增加干燥剂对样品降解的影响。
三、材料
3.1 盐溶液
饱和盐溶液可以用于在不同温度下维持特定的湿度水平。当自制湿度盐溶液时需要注意至少提前24小时准备并确保溶液始终处于饱和状态。也可以购买商业化的湿度胶囊。
四、实验
4.1 ASAP方案设计
1. 在设计ASAP方案时,现有样品稳定性的知识可以应用到方案设计中。应该设计特定条件和时间点以使样品降解到规定的限度。最理想的时间点是在规定时间的一半以上和不超过规定时间的150%之间。
2. 在ASAP研究中至少需要四个条件,但最好使用至少五个或六个条件。
3. 为了确定准确的初始时间点的测量结果,并减少误差。通常,大多数时间点只进行一次分析,但在一个中间条件和时间点上,需要进行多次重复分析,以确定相对标准偏差(RSD)。然后可以将该值应用于整个研究的数据,以减少测试样本的数量。
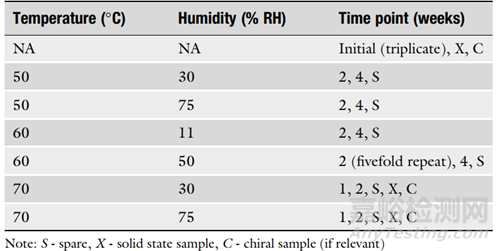
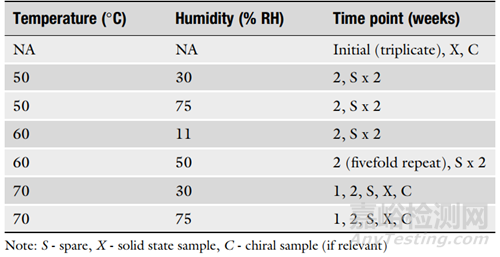
4. 在设计ASAP方案时,考虑研究的目的也很重要。表1是固体口服制剂的典型方案,表2是货架寿命研究的典型方案。建议使用至少五个条件,初始样品至少进行两次分析,中间条件和时间点进行三次分析。对于可能用于监管申请的货架寿命设置研究,建议使用至少六个条件,初始样品进行三次分析,并对中间样品进行五倍重复。
▲表1-固体口服制剂的典型ASAP方案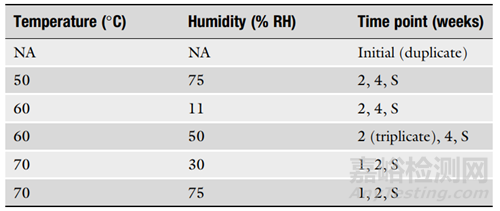
▲表2-货架寿命研究的典型方案
5. 温度和湿度在ASAP研究中应该独立变化,如表1和表2中所示的方案所示,否则无法确定每个变量的独立效应。
6. 如果对样品的稳定性的认知有限,可以在方案中设置多个备用样品,如表3所示。
▲表3-灵活可变的方案示例
7. ASAP研究的一个重要准则是,在研究过程中样品的物理形式不发生变化。
对于制剂的ASAP研究,这些界限适用于辅料和活性成分,因为辅料形式的改变也可能改变活性成分降解的动力学性质。
8. 与固体相比,对于溶液制剂,ASAP方案通常要简单得多,因为湿度对大多数溶液的降解没有影响,所以只需要变化温度。如表4所示,在这种情况下,至少需要三个条件。
▲表4-液体制剂研究的典型ASAP方案
9. 对于所有的方案,在每个条件下添加备用样品是必要的。如果在特定时间点对样品的分析存在问题,并且需要进行重复分析,就可以采用备用样品;或者延长备用样品的放置时间来使样品进一步降解以接近质量标准极限。
10. 在设计ASAP研究的方案时,应关注检测项目、检测方法以及时间点和条件。对于典型的药物物质或固体口服制剂,使用具有稳定性指示性HPLC进行杂质分析最常用。
11. 在最后一个时间点的最严酷条件下,应考虑药品的物理状态(外观)和手性杂质,以确认在研究过程中未发生物理形态或手性的变化。如果认为转化为对映异构体是主要的降解机制,则应在所有条件和时间点进行手性分析。
12. 当研究可能用于支持监管申请中的有效期声明时,也应考虑详细描述分析过程。对于不同的制剂类型,其他分析方法可能更相关;对于溶液制剂,颜色变化可以用来监测降解。此外,可能需要确认在研究过程中pH值未发生变化,或者没有发生沉淀。如果在ASAP条件下观察到活性成分的沉淀,则不应使用该条件下的数据进行ASAP模型分析,因为一些活性成分可能已经发生了物态变化,并且降解动力学也可能受到影响。
13. 在设计方案时,应根据每个分析所需的样品量计算每个时间点的样品量。对于样品量有限的制剂,可在每个时间点和条件下仅使用一个或两个制剂。
4.2 实施ASAP研究
1. 选择有代表性的批次进行ASAP研究。
2. ASAP样品可以使用饱和盐溶液控制湿度的烘箱存储,使用同时控制温度和湿度的稳定性室存储,或使用自动化机器人存储系统存储。
3. 测量样品所暴露的准确温度和湿度数据非常重要,特别是用于支持货架期申请的预测研究。可以使用温湿度传感器来检测,还可以使用同时测量温度和湿度的探头,并将其与样品和盐溶液一起放置在密封罐或干燥器中。
4. 在ASAP研究过程中发生的所有降解都是由温度或湿度的影响引起的。如果样品对光敏感,需要在ASAP条件下做避光保护。
5. 尽可能减小ASAP研究样品分析的误差,从而减小预测结果的误差。因此,理想的做法是减少检测。可以通过错开起始点使实验重点在同一天,这样可以在一个序列中分析所有样品。初始样品和检测时间点之前的样品可以根据需要存放在冰箱中。
4.3 收集数据
1. 对于ASAP研究,通常对杂质用面积归一化法计算是足够的。对于可能用于监管申请的有效期确定研究,需要使用外标法法计算。
2. 对样品在整个HPLC运行过程中进行随机排序,包括重复的初始样品和中间样品,以避免系统误差影响后续的预测。
4.4 审核数据
1. 在开始任何建模之前,完成分析后应先审核数据。
2. 对于杂质分析,需要从数据中确定可能限制有效期的降解产物。
3. 如果形成多个降解产物,需要单独对它们进行建模,以确定是限制有效期的关键杂质。
4. 降解产物的总水平也应考虑,在多个降解产物在低水平时,总杂已经到限度水平。
5. 确定主要降解产物后,应审核数据以确认在每个条件下样品是否至少降解到限度要求的一半,并且没有过度超过限度要求(限度的150%)。如果ASAP研究中的降解水平超过了限度,降解的动力学可能会发生变化。因此,重要的是保持在限度的大约150%以下。这样做可以最大程度地减小在生成ASAP模型的误差。
6. 可能需要从模型中排除没有发生降解的条件和降解超过150%限度的时间点,因为降解的动力学可能会发生变化。
7. 确定要在ASAP模型中使用的条件和时间点后,应多次重复计算初始样品的平均值,并计算初始和中间条件/时间点的重复的相对标准偏差(RSD)。然后,将RSD值中较高的值应用于整个研究的数据。
8. 确定用于拟合数据的降解动力学。在大多数情况下,线性拟合就足够了。
4.5 建模ASAP数据
1. 有商业化的软件可用于建模,如ASAP(Accelerated Stability Assessment Program)。
2. 使用在每个条件下得到的降解速率来带入阿伦尼乌斯方程,并确定阿伦尼乌斯参数。
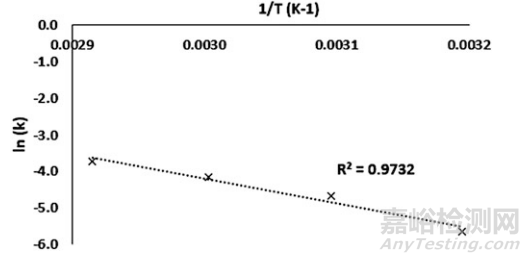
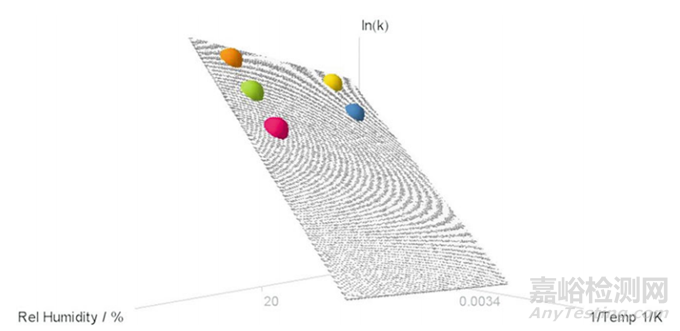
3. 可以通过2D或3D可视化来展示模型,具体取决于样品类型(图1和图2)。
▲图1-典型液体样品ASAP模型
▲图2-典型固体样品ASAP模型
4. ASAP软件通常利用对重复样品的存储和分析计算出的误差来确定在每个条件下达到限度所需的时间误差。此误差随后传递到最终的阿伦尼乌斯参数,从而为预测长期条件下的降解提供置信限。
5. 评估模型。阿伦尼乌斯常数应在预期范围内,活化能通常应在15-40 kcal/mol的范围,B在0到0.1之间[4]。每个条件应在确定的误差范围内与模型拟合。这可以通过R平方项(理想情况下应大于0.9)和残差来确定。
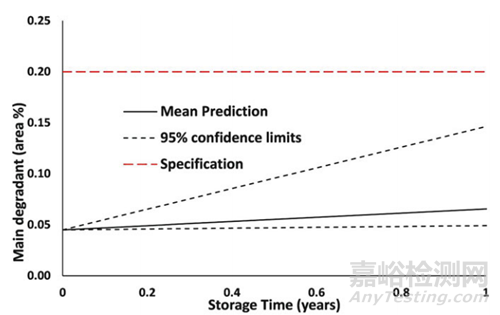
6. 生成可靠的模型后,可以对不同储存条件进行预测。这些预测可以用于处方筛选、预测复检期或货架寿命。图3显示了一个典型的ASAP预测与主要降解产物0.2%限度的关系。可以看出,这个例子的预测支持在上限95%置信限内的12个月货架寿命。
▲图3- ASAP预测货架期
五、包装预测
1. 要预测包装产品的货架寿命,首先需要通过实验或计算确定包装的湿气透过率(MVTR)。聚合物片材或薄膜有标准的测试方法可用(ASTM E96),药品瓶和泡罩有标准的测试方法可用(ASTM D7709)。
2. 利用动态蒸汽吸附曲线(DVS)确定产品在不同湿度下吸湿的能力。
3. 使用市售的现成软件或制药公司定制的软件预测包装内的湿度随时间的变化。这些变量包括片剂数量、大小以及瓶型包装中的干燥剂用量。
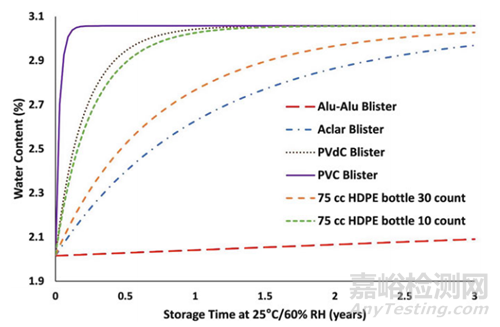
4. 利用ASAP研究中的阿伦尼乌斯参数,可以将包装内的湿度转换为存储时间内包装内的降解水平。通过这种方法,可以比较不同的包装类型和配置,如图4所示,甚至无需进行任何包装产品的稳定性测试。
▲图4- 典型包装预测结果图
六、总结
预测稳定性和ASAP研究在药品研发和商业化周期中具有广泛的应用。这些应用包括配方筛选、在开发早期设置初始复验期和货架期、控制策略支持、质量标准的制定和制定依据、研究批次间变异性[8]、研究药物物质粒子工程对药品稳定性的影响,以及支持包装变更。
ASAP还可以评估在药物物质或药品开发过程中的任何变化对化学稳定性特性的影响。如果ASAP研究证明与现有药物物质或药品等效,则在那时可能不需要对新的药物物质或药品进行进一步的稳定性测试。ASAP研究还可用于处理开发过程中的偏差,根据ASAP研究数据进行预测,以帮助定义药品的合适偏差声明。同样,如果发生了偏差,则可以使用ASAP数据和预测来证明批次的适用性。
参考文献
1)Methods for Stability Testing of Pharmaceuticals
2)Waterman K, Adami R (2005) Accelerated aging: prediction of chemical stability of pharmaceuticals.
3)Waterman K, Carella A, Gumkowski M et al (2007) Improved protocol and data analysis for accelerated shelf-life estimation of solid dosage forms.
4)Waterman K, Colgan S (2008) A science-based approach to setting expiry dating for solid drug products.
5)Waterman K (2011) The application of Accelerated Stability Assessment Program (ASAP) to Quality by Design (QbD) for drug product stability.
6)Waterman K, Swanson J, Lippold B (2014) A scientific and statistical analysis of accelerated aging for pharmaceuticals.
7)Waterman K, Macdonald B (2010) Package selection for moisture protection for solid oral drug products.
8)Colgan S, Watson T, Whipple R et al (2012) The application of science- and risk-based concepts to drug substance stability strategies.