摘 要 Abstract
合规风险是启动药品注册核查考虑的重要因素。本文对启动注册核查的合规风险因素及申办者合规管理进行了探讨,并提出第三方专业机构参与药品研发全生命周期合规管理的建议,以期为申办者、研究机构、外包服务机构等研发生产主体应对基于风险的注册核查合规管理提供借鉴。
Compliance risk is an important triggering factor in initiating drug registration inspection. This paper discussed the compliance risk factors of starting registration inspection and the compliance management of sponsors, and proposed that the third-party professional institutions should participate in the compliance management of the whole life cycle of drug research and development, expected to provide reference for sponsors, research institutions, outsourcing service agencies and other R&D and production bodies to cope with the risk-based registration inspection compliance management.
2022 年1 月1 日起实施的《药品注册核查检验启动工作程序(试行)》(以下简称《启动工作程序》)对参与药学研制、药理毒理学研究、临床试验以及生产制造的相关单位和机构,即“全链条”研发生产主体及药品研发“全生命周期”合规风险提出核查要求,明确了启动注册核查的对象、启动注册核查的风险考虑因素、核查原则和程序等问题。《启动工作程序》的实施应当引起申办者、研究机构、外包服务机构等研发生产主体的高度重视。“研发生产主体”“风险因素”“重大不合规”“质量管理体系”“有因检查”等监管概念构成了药品注册核查启动及持续监管的基本框架。
一、注册核查概述
《药品注册管理办法》第四十五条规定,药品注册核查是指为核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等,对研制现场和生产现场开展的核查活动,以及必要时对药品注册申请所涉及的化学原料药、辅料及直接接触药品的包装材料和容器生产企业、供应商或者其他受托机构开展的延伸检查活动。药品注册核查的范围包括药品上市许可申请,涉及药品生产过程中处方工艺或生产批量重大变更,或者新增临床试验数据等补充申请。
注册核查对象为药品研发生产主体。根据《启动工作程序》及相关配套文件规定,研发生产主体包括参与药学研制、药理毒理学研究、临床试验以及生产制造的相关单位和机构,覆盖范围广泛,见表1。
启动注册核查考虑的风险因素包括品种因素和研发生产主体合规因素。本文主要讨论研发生产主体合规因素,包括研发生产主体风险等级、既往接受核查情况及重大不合规问题等。同时,因审评过程中发现申报资料真实性存疑或者有明确线索举报的,监管部门可根据需要对药品注册申请启动有因检查。
对于因合规因素启动的注册核查,主要包括药品研制现场核查和药品生产现场核查。在药品研制现场核查中,国家药品监督管理局食品药品审核查验中心(以下简称药品核查中心)通过对药品研制合规性、数据可靠性进行检查,对药品注册申请的研制情况进行核实,对原始记录和数据进行审查,以确认申报资料真实性、一致性等。在药品生产现场核查中,药品核查中心通过对申报品种的数据可靠性进行实地核查,以核实申报资料的真实性及商业化生产规模下相关生产和质量控制活动与申报资料的一致性等。
合规因素风险等级分为高风险、中风险和低风险。合规因素高风险主要包括真实性问题、贿赂问题、仅用于中国注册的生物等效性(BE)试验由境外机构完成、药品生产企业尚无同剂型品种上市、药品生产企业和关键临床试验数据研究机构近3 年内未接受过国内外监管机构注册核查。合规因素中风险主要包括研发生产主体间的利益关系。对高风险等级的药品注册申请按照100% 的比例启动注册核查,对中风险等级的药品注册申请按照20%~40% 的比例启动注册核查,对低风险等级的药品注册申请按照10%~20% 的比例启动注册核查。
对于注册核查结论明确的,国家药品监督管理局药品审评中心(以下简称药品审评中心)予以接收。对于注册核查结论不明确的,药品审评中心与药品核查中心沟通,待注册核查结论明确后予以接收。注册核查发现的申请人和(或)被核查单位的问题,可作为药品核查中心后续判断注册核查风险、确定核查组织模式和方法及核查地点的重要依据,也可作为药品审评中心后续启动注册核查合规因素划分的依据。
二、合规风险因素
(一)利益输送
《启动工作程序》规定申办者与临床试验项目研究机构之间,或临床试验项目研究机构之间存在相关“利益关系”是合规中风险因素[1]。《启动工作程序》未明确“利益关系”的定义。《关于加强药品审评审批信息保密管理的实施细则》将“利益关系”主要界定为投资、持股及谋取不正当利益,由于该法规仅适用于审评审批工作人员与医药企业的“利益关系”,可能无法涵盖《启动工作程序》中“利益关系”的完整范畴。根据公司治理和上市相关规则,存在利益关系的相关方还应包括客户、供应商、债务人、债权人、实际控制人、创始人等。
中国临床研究能力提升与受试者保护高峰论坛(CCHRPP)发布的《临床研究利益冲突管理共识(试行版)》中将“利益冲突”界定为两种表现形式,一种是经济利益冲突,另一种是其他利益冲突。经济利益冲突主要表现为:相关人员及其直系亲属在申办者(包括受托CRO)拥有股份或担任高级职务以及从申办者获得顾问费、专家咨询费、礼品、宴请及旅游等各种费用;相关人员及其直系亲属拥有研究相关知识产权,包括但不限于专利、商标、版权或转让协议等。其他利益冲突指经济利益以外的利益冲突,如申请基金课题、获得荣誉或奖项、扩大声望与影响力等造成的利益冲突;学术会议赞助、资助发表论文、彼此间存在竞争关系也会产生利益冲突等[2]。
为避免因“利益关系”风险因素而启动注册核查,申办者应在临床试验启动前就相关方之间的“利益关系”开展专项尽职调查,并要求相关机构在与申办者签署的合同中承诺不存在利益关系及相关约束机制。一旦发生因未披露的“利益关系”导致的风险,申办者可向责任方主张解除合同、损害赔偿等补救措施。
(二)重大不合规问题
《启动工作程序》具体规定了5 种类型的重大不合规问题。此外,药品审评中心在临床试验和药学研制与生产中重点关注的重大不合规问题还包括质量管理体系(QMS)是否合规,受试者的权益是否得到保障,临床试验或研发数据的真实性、可靠性及完整性是否存在问题,法规依从性是否有保证等。关于质量管理体系的合规性,可从临床试验及药品生产两个角度考量,本文主要探讨临床试验和药品生产QMS关注的合规问题。
1. 临床试验质量管理不合规
申办者是临床试验数据质量和可靠性的最终责任人,因此,申办者应履行管理职责,建立研究和管理团队,对临床试验全过程实施质量管理。临床试验质量管理体系应覆盖临床试验全过程,包括试验设计、实施、记录、评估、报告和文件归档,重点是受试者保护、试验结果可靠及相关操作合规。在临床试验质量管理中,常见的不合规问题包括:①一般的方案违背和(或)未上报伦理;②临床试验记录不符合逻辑;③临床试验用药品未在医院信息系统(HIS)体现;④伦理审查记录不完整、不准确或未及时递交伦理审查,伦理委员会未对项目修订方案及知情同意书审查;⑤临床试验生物样本等记录不规范或不完善;⑥试验方案执行(分工任务等)由未经主要研究者授权的人员执行;⑦试验用药品部分原始记录不完整,规范不准确或缺失;⑧不良事件(AE)判断不合理、描述不规范、记录不及时;⑨临床试验原始记录不完整、不规范或不准确等[3]。
2. 药品生产质量管理不合规
药品生产质量管理体系应涵盖影响药品质量的所有因素,确保所生产的产品符合申报工艺和质量要求,并最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险。在药品生产质量管理中,常见的不合规问题包括:①存在严重偏离《药品生产质量管理规范》等相关法律法规,以及可能对产品质量带来严重风险或者对使用者造成危害的情形;②编造生产、检验记录和数据;③隐瞒记录和数据,无合理解释地弃用记录和数据,或以其他方式选择性使用记录和数据导致对药品质量评价产生影响;④故意损毁、隐匿记录和数据或者其存储介质等破坏记录和数据真实性的情形;⑤无法证明能按照申报的上市商业化生产条件实现持续稳定生产;⑥存在严重的数据可靠性问题,关键数据和记录无法溯源,导致对药品质量的评价产生影响等[4]。
三、有因检查
《启动工作程序》第二十九条规定,审评过程中发现申报资料真实性存疑或者有明确线索举报等,需要现场核实的,应按相关程序对药品注册申请启动有因检查[1]。
1. 真实性问题
真实性问题可启动核查程序。所谓真实性问题,包括但不限于编造或者无合理解释地修改相关信息和数据,隐瞒相关记录和数据、无合理解释地弃用记录和数据或以其他方式选择性使用记录和数据,故意损毁、隐匿记录和数据,关键数据和记录无法溯源,申报资料与原始记录不一致且影响结果评价等[5]。
2. 举报
有明确线索的举报亦可启动核查程序。申办者应重点关注临床前及临床试验开展过程中的合规问题,尽可能降低来自内部或外部的举报风险,相关合规问题包括但不限于:①试验用药品(如试验用药品的供应、存储、回收、销毁、服用依从性、生产、包装、标签等合规)。②知情同意(如知情同意书合规,或知情同意程序合规)。③伦理委员会(如缺少伦理委员会意见、伦理委员会递交程序合规、伦理委员会组成合规)。④受试者保护(如试验设计,个人数据保护,受试者安全和权益保障,受试者保险、补偿、赔偿,受试者付款等合规)。⑤监管(如缺少合规的监管部门批准文件、监管部门沟通和应对程序等)。⑥临床试验管理[ 如方案、病例报告表(CRF)、日记卡、调查问卷设计的合规,数据管理、监查、稽查、文件控制、统计分析、临床试验报告合规等]。⑦临床试验机构(如方案依从性,包括入排标准、安全性报告、CRF 和日记卡合规等)。⑧其他方面[ 如组织和人员、设施和设备、资格和培训、标准操作规程(SOP)、源文件、临床试验合同等合规]。
临床试验涉及众多参与方,包括申办者、医疗机构、研究者、受试者、CRO、SMO、第三方检测机构、保险公司、招募机构等。申办者是临床试验的最终责任人,但临床试验各参与方的合规问题也会影响临床试验的合规,为此,笔者建议申办者在临床试验项目启动前对相关供应商开展合规尽职调查,完善申办者与第三方签署的合同,并有效开展供应商“全链条”和“全生命周期”合规管理,尽最大可能防患于未然。
四、风险等级动态调整和合规整改
1. 风险等级的动态调整
合规因素风险等级并非固定不变,而是根据后续注册核查情况适时调整。其中,风险等级升高的情形为:既往注册核查过程中发现存在重大不合规问题,且经后续注册核查发现相关问题仍存在的,合规因素风险升级为高风险。风险等级降低的情形为:高风险后续经过连续两次注册核查,核查结论均为通过且未发现重大不合规问题的,降级为中风险;中风险后续经过连续两次注册核查,核查结论均为通过且未发现重大不合规问题的,降级为低风险。风险等级不调整的情形为:研发生产主体间存在利益关系的,风险等级为中风险且风险等级不调整;仅供中国注册的BE由境外医疗机构完成,相关医疗机构风险等级为高风险且不调整;对于发现存在真实性问题、贿赂问题,自查实之日起五年内高风险等级不调整。
对于上述存在一定“劣迹”的研发生产主体,需特别关注后续注册核查、检查的合规管理及合规体系的建设。
2. 合规整改
存在合规问题的研发生产主体,药品审评中心给予整改的机会。若整改后研发生产主体能够解决相关合规问题的,则降低合规风险等级;不整改或整改后仍存在相关合规问题的,提高或不调整合规风险等级。有鉴于此,研发生产主体应梳理既往接受核查情况、与各研发生产主体间是否存在利益关系及是否存在重大不合规问题,按照梳理情况进行相应整改,并建立健全覆盖非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告的药品全生命周期的合规管理体系。
五、申办者合规管理
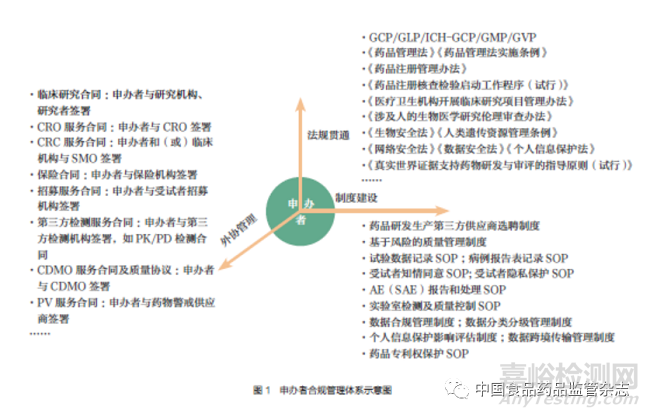
申办者可将临床试验部分或全部工作委托给CRO 或根据需要聘请其他研发生产主体参与药品研发。若受托研发生产主体自身受到有因检查或发生重大不合规问题以及其他不合规因素而触发注册核查,由于申办者是临床试验数据质量和可靠性的最终责任人,除申办者的药品注册申请将受影响外,申办者自身合规情况也可能受到挑战和质疑。若申办者对其他研发生产主体尽到合规管理责任后(如尽职调查、持续监督管理等),申办者能否降低因其他研发生产主体不合规对自身产生的不利影响是值得思考的。同时,若申办者注册核查未能通过或发现其他重大不合规问题的,可能进一步导致申办者其他药品注册申请的合规风险因素升高。鉴于此,申办者应积极履行管理职责,建立研究和管理团队,对研发生产“全链条”和药品研发“全生命周期”实施合规管理,并建立完善的合规管理体系,笔者建议申办者可基于图1 所示建立合规管理体系。
1. 法规贯通
《药品管理法》《药品注册管理办法》《药物临床试验质量管理规范》《药物非临床研究质量管理规范》《药品生产质量管理规范(2010 年修订)》等法规是我国药品研发监管的主要依据,除此之外,立法和监管部门还就研究机构、伦理审查、数据核查、药物警戒、药品生产、数据安全、人类遗传资源管理等发布了相关法律法规和规范性文件,并开展基于风险的现场核查。因此,申办者应全面了解监管法规动态和现场核查要求,及时调整合规管理体系,严格依法开展药品研发活动。
2. 外协管理
申办者应建立第三方服务机构筛选、合同管理等合规制度,对第三方服务机构进行尽职调查,了解第三方服务机构既往接受注册核查情况;选择合格的第三方服务机构并与其签署权责明确的合同,在合同中明确相关的违约责任和监督管理要求等;建立第三方供应商监督管理制度,加强对第三方服务机构外包工作的监督管理。
3. 制度建设
为规范药品研发活动合规开展,申办者可在企业内部建立相关的内控制度,并严格要求各参与方在药品研发全生命周期活动中遵守相关的内控要求。
六、第三方专业机构合规管理
申办者作为临床试验数据质量和可靠性的最终责任人,应充分理解注册核查合规风险,提前把关研发生产主体合规风险因素,选择合适的临床试验参与方并对其进行合规监督管理,积极开展合规培训,构建基于风险的合规管理体系。考虑到申办者临床研究供应商管理可能存在流于形式、合规部门不熟悉临床试验GCP合规、临床质量管理依赖CRO但CRO 对合规管理没有实质性约束义务和担当等情况。笔者建议申办者可以尝试引入专业的第三方临床合规管理机构,一方面,能够协助申办者提升临床合规管理水平并构建契合特定临床研究需要的合规管理体系;另一方面,也为监管机构评估申办者合规风险及确认申办者落实临床研究合规要求提供有效依据和保障。