您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-04-10 14:46
近日,山东百骏生物科技有限公司研发的“HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)”获批上市,下面嘉峪检测网与您一起了解一下HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)在临床前研发阶段做了哪些实验。
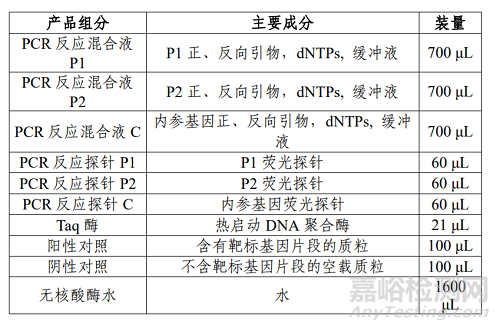
1、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的主要组成成分
产品主要组成成分见下表
2、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的预期用途
本产品用于体外定性检测人外周静脉全血样本中 HLA-B*1301 等 位基因,不能区分 HLA-B*1301 基因纯合型和杂合型。
本产品用于计划服用氨苯砜治疗麻风病等疾病患者的用药指导, 以避免氨苯砜综合征不良反应。 氨苯砜综合征(DHS)是由临床服用氨苯砜引起的严重副作用, 属于重症药物不良反应(ADR)的范畴。本病于 1949 年被首次报道, 1951年被 Allday 和 Barnes 命名为“D.A.D.P.S. syndrome” (氨苯砜综 5 / 17 合征)。氨苯砜综合征是一种非剂量依赖性的药物超敏反应综合征 (DIHS),以突然发生的丘疹或剥脱性皮疹、发热、淋巴结肿大、单核 细胞增多以及内脏损害等为临床表现特点。临床发病率为 0.5-3.6%, 死亡率高达 10%左右,严重威胁患者的生命健康。
根据 2013 年发表于《新英格兰医学杂志》期刊的文献,HLAB*1301 作为氨苯砜超敏反应综合征(DHS)生物学标记物,两者的相 关性 OR 值为 20.53,P 值为 6.84×10−25,具有显著的统计学意义, 证实 HLA-B*1301 与氨苯砜超敏反应综合征(DHS)发生紧密相关。 携带 HLA-B*1301 等位基因单个拷贝的个体(杂合携带者),服药后发 生 DHS 的风险是不携带该等位基因个体的 33.6 倍;携带 HLA-B*1301 等位基因两个拷贝的个体(纯合携带者),服药后发生 DHS 的风险是不携带该等位基因个体的 100.7 倍。
2021 年,中华医学会皮肤性病学分会药物不良反应研究中心发表 的《Stevens-Johnson 综合征/中毒性表皮坏死松解症诊疗专家共识》中提出“HLA⁃B*1301 与氨苯砜、柳氮磺吡啶和复方磺胺甲噁唑诱发的药物超敏反应综合征及 SJS/TEN 相关”,治疗前检测风险 HLA 基因可预防 SJS/TEN 等重症药物不良反应。
本试剂盒的检测结果仅供临床参考,对患者个体化治疗的选择应结合其症状/体征、病史、其它实验室检查及治疗反应等情况综合考虑, 不能以本试剂盒检测结果作为临床是否用药的唯一依据。
3、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的检验原理
本试剂盒采用实时荧光定量 PCR 方法结合水解探针技术,对 HLA-B*1301 等位基因的两个特定区域进行特异性扩增,通过扩增曲线和 Ct 值来判断该个体是否携带 HLA-B*1301 等位基因。
4、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的主要原材料研究
4.1 主要原材料的选择
主要原材料包括:引物、探针、Taq 酶、dNTP 和阴阳性对照品等, 原材料均通过外购的方式获得。其中引物和探针为开发人自行设计, 由合成公司采用 DNA 合成仪合成,经纯化后获得。 通过功能性试验,筛选出最佳原材料和供应商,制定了各主要原 材料质量标准并经检验合格。
4.2 企业参考品设置
开发人设计了完整的企业参考品(RM(P001)),包括企业准确度 参考品、企业特异性参考品、企业检出限参考品、企业精密度参考品。 参考品采用临床样本制备而成。组成如下:
(1)阳性参考品 10 份,命名为企业准确度参考品(P01~P10)。来源于经检测为 HLA-B*1301 纯合型阳性及 HLA-B*1301 杂合型阳性的 样本。
(2)阴性参考品 10 份,命名为企业特异性参考品(N01~N10)。来源于 经检测为 HLA-B*1301 阴性的样本。
(3)精密度参考品 2 份,命名为企业精密度参考品(PC01~PC02)。为使用 HLA-B*1301 阴性的样本作为基质,将 HLA-B*1301 杂合型阳 性样本稀释至指定浓度后获得。
(4)检出限参考品 1 份,命名为企业检出限参考品 LD01。为使用 HLA- 7 / 17 B*1301 阴性的样本作为基质,将 HLA-B*1301 杂合型阳性样本稀 释至指定浓度后获得。
5、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的生产工艺和反应体系研究
开发人对试剂盒反应体系的研究包括靶标序列的选择、引物探针 浓度的确定、Taq 酶浓度的确定、dNTP Mix 浓度的确定、镁离子浓度 的确定、阴/阳性对照品配方的确定等。对反应条件的研究包括 PCR 退火温度、扩增循环数、扩增反应时间、PCR 反应体积等。通过功能性实验,最终确定了最佳的反应体系。
开发人根据试剂盒中试剂及组分的主要生产工艺的研究结果,确定了最佳的生产工艺。
6、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的分析性能评估
该产品分析性能包括最低检出限、精密度、准确度、分析特异性 (交叉反应、干扰试验)、核酸提取纯化性能等。开发人开展了有效运行的质量管理体系下生产的 3 批产品在适用机型上的性能评估。
在最低检出限研究中,开发人对将 HLA-B*1301 杂合基因稀释至指定浓度的样本进行 20 次重复检测,将至少 18 次检测结果 CT 值≤ 30 且扩增曲线为指数扩增曲线的浓度作为 P1、P2 反应体系的各自最低检出限。另采用 3 批试剂进行检出限的验证,符合检出限的性能要求,即最低检出限为 5ng/μL。
在准确度研究中,开发人选取了120例测序结果为 HLA-B*1301 阳性的样本(其中 7 例纯合型),采用 3 批试剂按说明书要求进行检 测,结果显示阳性符合率 100%。
在精密度研究中,开发人针对 HLA-B*1301 阴性,HLA-B*1301 弱 阳性和 HLA-B*1301 中/强阳性三个水平的临床样本进行了精密度评 8 / 17 价。分别评价了本产品的室内和室间精密度,试验包含不同地点、操作者、仪器、运行、批次等影响因素,结果显示 CT 值 CV 值均符合性 能要求。分析特异性实验涵盖交叉反应研究及干扰因素研究。
交叉反应评价中,开发人采用了自然人群中 HLA-B 区域携带频率大于 4%的 15 种同源性序列进行了交叉反应研究,经验证,所选择 15 种同源序列样本 与本产品均不产生交叉反应。
干扰研究实验中,咖啡采用在中低浓度的 HLA-B*1301 阳性及阴性样本中加入干扰物质的方法进行验证,干扰实验结果显示,样本中内源性及药源性干扰物质不大于以下浓度时,试剂盒各项检测结果符合要求:血红素 300g/L、甘油三酯 6mmol/L、胆红素 25 μmol/L、西替利嗪 500μg/L、泼尼松 90μg/L、克拉霉素 5μg/mL、伊曲康唑 4μg/mL、 阿维 A1000ng/mL、甲氨蝶呤 30 μmol/L、氨苯砜 4.82mg/L。
针对核酸提取纯化步骤,开发人将试剂盒配套使用的核酸提取试剂与已上市质量较好的提取试剂对全血样本的 DNA 提取效率进行平行比对,结果显示核酸提取效率相当,并对配套使用的核酸提取试剂提取后 DNA 的纯度、浓度,精密度和抗干扰能力进行了评估,性能均可满足试剂盒检验要求。
7、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的阳性判断值的确定
使用ROC曲线法,采用HLA-B*1301杂合、纯合阳性及阴性全血 样本共计260例,利用考核试剂P1及P2反应体系的检测结果与样本测 序结果进行一致性比对分析。通过ROC曲线计算,最终确定检测基因 片段P1及P2的阳性判断值,均为Ct值≤30。 同时通过对上述260例样本的内参基因检测结果进行置信区间分 9 / 17 析,最终确定了内参基因检测结果的合格标准为Ct≤30。
8、HLA-B*1301 基因检测试剂盒 (PCR-荧光探针法)的稳定性研究
开发人对本产品的货架效期稳定性、开瓶稳定性、冻融稳定性、 样本稳定性进行了研究,确定了在各种条件下本产品及样本的有效保存时间。
货架效期稳定性:采用3批试剂进行研究,将试剂盒保存在-20±5℃ 条件下,分别于保存第0月、第3月、第6月、第9月、第11月、第12月、 第13月和第14月时取出试剂盒,对试剂盒的分析特异性、检出限、测量准确度、测量精密度四项性能指标进行检测,确定产品在规定的储 存条件下,可稳定保存12个月。
开瓶稳定性:将试剂盒于室温下开瓶解冻后,再置于-20±5℃冷冻 条件下冷冻保存,参考实验室日常检测条件下使用频次及使用方式, 分别设置开瓶后第1天、第2天、第3天、第4天、第5天、第6天、第7天 分别对准确度、分析特异性、测量精密度、检出限指标进行评估,试剂盒在开瓶冻融后短期(7天内)各性能均符合产品技术要求。同时, 开发人使用开瓶复融试剂完成长期(7个月)稳定性研究,各性能均符 合产品技术要求。最终开瓶稳定性结论为:在不同使用频次下,试剂 盒性能均满足要求,确定试剂盒开瓶冻融稳定性有效期为6个月。
冻融稳定性:试剂盒置于-20±5℃冷冻条件下冷冻保存,期间分次 取出,室温放置至试剂盒内组分完全融化后再重新放置 于-20±5℃冷 冻条件下冷冻保存。分别在冻融第1次,第2次,第3次,第4次、第5次、 第6次、第7次设取样检测时间点。对于不同冻融次数的试剂盒分别评 价分析特异性、检出限、测量准确度、测量精密度四项性能指标,结 果均合格。试剂盒反复冻融稳定性结论为不多于6次。
样本稳定性:开发人对全血样本、提取后的DNA样本进行了样本 稳定性研究,研究结果表明:全血样本短期(30天内)可保存于-20±5℃, 反复冻融不宜超过2次,长期保存可置于-70℃以下,但不宜超过6个月, 反复冻融不宜超过3次;提取后样本短期(30天内)可保存于2~8℃, 长期(6个月内)可保存于-20±5℃,反复冻融不宜超过3次。

来源:嘉峪检测网


