近日,诺和诺德公布了其2022年的财务报表,口服司美格鲁肽(Rybelsus)的年销售额达到了15亿美金(1),这是第一个在商业上取得成功的口服大分子药物。它很大程度上改变了大分子不能口服的传统理念,也引发了口服大分子药物的研发热度。通过口服递送技术,将注射剂改成口服,它的成功表明了提高患者的依从性,在慢性疾病治疗中具有巨大的医学价值。最近口服大分子的文章很多,但大部分主要集中在引用和概括已发表文章的结果。本系列两篇文章不仅概述了一些已发表文章的结论,同时提供原创性的分析和理解。本文将涵盖了口服大分子技术、临床开发、药监、知识产权和商业化,是一篇从全产业链角度通盘分析的文章。
1.技术篇
1.1口服大分子的策略
口服药物是最常用的剂型,因为它们简单易用,提高了患者的依从性。口服剂型在小分子药物中更为成功,但由于大分子药物的理化特性和胃肠道降解,口服大分子的可能性在很大程度上被排除了。但与此同时,随着生物科学的快速发展,很多新疗法的发现都转向更大的分子。除了少数例外,大多数生物制剂都是通过注射剂给药的,这对患者和护理人员来说是挺麻烦的事。因此,医护和患者的这些未被满足的需求尚未得到满足,口服生物制剂可以解决这个问题。
口服生物制剂的挑战和技术发展已有几篇综述文章中进行了总结(2,3)。主要目标是使药物能够穿过生物屏障,最大限度地减少胃肠道中pH变化和酶引起的药物降解,同时保持生物系统的完整性。任何口服大分子的药物递送技术开发和评估都必须满足这三条标准,这是开发成功的基础。例如,Emisphere的Eligen技术使用载体改变药物分子的构象或者水合球状态,使其可跨膜运输。SNAC(N-[8-(2-羟基苯甲酰基)氨基]辛酸酯)是来自Eligen的载体的一个例子。其机制是药物和载体之间有一个弱的物理相互作用,并且在进入全身循环后分开。此外,载体通过创造局部碱性环境减少胃蛋白酶在胃中的活性,从而最大限度地减少药物降解。药物通过细胞间运输被吸收进入体内,同时保持膜的完整性(注:这些工作原理直接摘自文献,其完整的工作原理还需商榷和进一步研究)。相比之下,通过使用某些种类的表面活性剂来打开紧密连接或者通过机械装置刺穿细胞膜的技术则相对来说太具有侵略性,会造成安全性的问题,笔者认为相对不那么可取。
迄今为止,获得监管机构批准并商业化的口服生物药屈指可数。这些药品主要采用促渗载体的技术实现口服吸收。例如MYCAPSSA是通过添加辛酸钠实现奥曲肽的口服(4)。Rybelsus通过添加SNAC实现司美格鲁肽的口服吸收(5)。这些载体均具有不同特征的脂肪酸结构。它们促进药物的吸收机制尚未完全得到阐明。一些文献报道了这两种载体都可以促进药物的跨细胞吸收,同时它们也会被吸收(6).
用促渗载体促进大分子吸收的研发始于Emisphere,他们的一些科学家使用微球进行药物递送实验(7)。在意识到使用有机材料制备微球可能产生毒性后,科学家们开始研究利用天然氨基酸制备微球。实验虽然得到了一些初步的成功,但是药物的吸收率仍然很低。于是,科学家们产生了通过对天然氨基酸进行改造修饰,以期得到更加安全、有效的新促渗载体的想法。他们合成了许多源自天然氨基酸的脂肪酸结构修饰物后,在临床前研究后,Emisphere在E414化合物取得突破,这也是SNAC的被发现过程。
SNAC只是人工合成和经过诸多实验和临床试验的载体之一。性质类似还包括5CNAC和4CNAB等其他Eligen载体,并且很多载体递送蛋白质和肽药物的能力已经进入到临床试验阶段评估阶段了。例如,5CNAC被研究用于口服降钙素(8),4CNAB用于口服胰岛素(9)。
据发表的文献报道,Eligen转运体可以与药物形成弱的物理相互作用,以增强药物的可运输构象。药物穿过细胞膜后(11,12),药物和载体从体循环中的稀释中解离。因此,促渗载体可以在维持细胞膜完整性的同时进行跨细胞药物递送。这是Eligen平台递送机制假设。我们在研究促渗载体时,应该打开思路,深入对生物膜的研究中,开发具促渗的载体同时,要考虑安全性,着眼于开发具产业化、实用性的高效递送和跨膜技术。
1.2.口服司美格鲁肽/多肽的研发要点
在SNAC的作用下,司美格鲁肽可以被口服吸收,但是生物利用度低,Rybelsus临床数据显示约0.5-1%。Rybelsus之所以成功,除了SNAC的递送功能,很大原因是因为司美格鲁肽的半衰期很长,每日给药方案可以使稳态时的药物浓度达到10倍量的累积。更重要的是,PK变异系数coefficient variation (CV)可以从单剂量给药时的150%大幅降低到稳态时的70~80%(13)。其他任何一款口服药物,其PK CV%都没有如此之高。但是,由于二型糖尿病和肥胖需要长期用药,血糖和体重的控制中,用药过程中,即使一个星期内,一两次甚至几次都没有吸收,也不会对血糖和体重的控制产生决定性的影响。然而,我们无法忽视的是,生物利用度低使得原料的用量大幅上升,原料成本成为了终端产品的主要成本,导致产品价格居高不下,使得普及性受影响,无法受惠更多病人。通常,仿制药的价格是原研的20%~50%,因此,将来Rybelsus的仿制药想参与市场市场,原料的成本必须大幅度降下来。再加上,对于吸收的高变异性,美国药监局(FDA)和欧盟药监局(EMEA)(FDA和EMEA综合评审)仍是有顾虑的。因为不稳定的吸收,可能会导致有些人日吸收过高产生超治疗性的药物浓度,而有些人日吸收过低产生亚治疗效果。
鉴于当前口服司美格鲁肽存在的问题,新口服技术需要在以下几个方面上具备优势:(1)降低产品的原料成本,从而降低终产品的价格,使更多患者获益;(2)降低口服吸收变异性。一是提高药效的一致性,二是可以达到更加优化的给药依从性。比如单剂量司美格鲁肽PK变异性如果低至一定程度,考虑到稳态时PK变异性会更低,给药方案可能可以和皮下注射一样,一周给药一次;(3)可以减少服药时食物和水的限制。目前Rybelsus需要早上空腹时口服,并且不能喝太多水(不超过约120mL)。如果新技术可以达到足够高的生物利用度,即使食物或者水产生一些影响,药物的吸收可能仍然可以被接受。潜在的方法包括新型功能性转运体,或新型制剂,或新的吸收部位(递送至受食物和水的影响较小的部位)。(4)这类口服技术的应用,可以扩展至其他大分子。
新型口服技术开发的一个方向是进一步改进、优化Eligen/SNAC类的载体分子。但是必须指出的是,开发的新载体分子很可能是一个新的化学实体,除了不需要进行临床疗效试验外,这种新化学实体辅料开发的工作量不亚于开发一个新化学小分子药物。药动药代,毒性、安全性、临床药理(包括人体药物代谢动力学)和药物相互作用等,都是必须要进行的,也存在一定的失败风险。Eligen的载体分子测试过很多种药物,SNAC由于Emisphere/诺和诺德临床前和临床做了大量的工作,显示其安全性好。而且专利过期,所以已经成为药物研究中的热门载体。
提高口服的生物利用度,特别是降低吸收的变异性,还有个好处,就是也适用于治疗窗口比较狭窄的药物。一个应用的例子是治疗静脉栓塞的口服肝素。肝素的治疗浓度窗口较窄,但Emisphere临床试验证明了肝素不但可以被口服吸收,而且变异性在可接受的范围内,达到了抗栓塞的临床效果(14, 15)。
2.知识产权、临床开发以及商业化综合考量的必要性
一个成功的505b(2)/2类新药项目,必须综合考量知识产权(IP)、临床开发以及商业化可行性。对于505b(2)项目而言,FDA要求必须有不侵权的认证才可以接受上市申请。
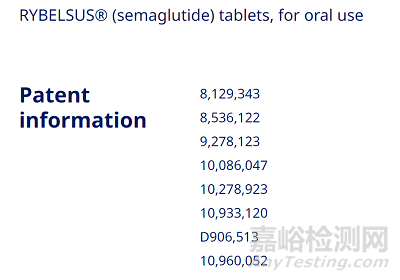
首先,对于这类项目,其本质上会使用现有的知识信息体系,所以或多或少,都会和现有的IP有所关联。特别是对于制剂改良项目,IP需要考虑Freedom to Operate和patentability两个方面。这当中,因为中国和美国(或其他国家)的IP体系有所不同,所以在不同区域的考量有所不同。以口服司美格鲁肽为例。诺和诺德申请了多项专利,在FDA orange book 上的专利清单就包括了8项其获授权的专利(图1),其权益有效期在2031-2033年左右。具体分析来说,其核心专利的目的是保护SNAC在司美格鲁肽口服制剂的广泛应用,以及其具体的制剂工艺。在中国,目前为止,其制剂专利对SNAC在司美格鲁肽口服制剂的保护范围非常有限,仅保护使用SNAC 300 mg ,即SNAC含量高或低于300 mg, 即不受专利保护(16)。(注:华东医药已经提起了对诺和诺德口服司美格鲁肽制剂的专利无效申请)。所以,不管是仿制还是505b(2)/2类新药,如何在不同区域,合理应用而不侵权参比药IP,是不同区域商业规划的一个关键考量。
临床开发上,不同区域的监管要求不同。在中国,对于小于40氨基酸大肽类药物,药监部门按照生物类似药来处理,所以即使仿制药,除了需要除了生物等效性试验外,还需要药效和安全性的三期比较性临床(17)。在美国,药监部门可根据实际情况,可以作为化学药物处理。所以,对于投资成本,包括时间成本,都需要加实际的考量。临床开发,和IP也有关联。口服司美格鲁肽的吸收和PK变异性非常之高(约150% CV),按照仿制药的生物等效性 (PK BE)要求,临床试验也非常之难。再者,其一个星期左右的PK半衰期,如果是使用一般PK BE的交叉设计,其临床试验的周期会较长。另外的问题,包括低剂量(3 mg)有大概25%的血样是检测不到药物浓度的(13),所以,无法应用传统的PK BE 统计方法。如何处理此类的数据,对药监部门和企业都是比较大的挑战。还有另一个非常重要的参数是,FDA要求体外溶出不仅药物的要有可比性,对于SNAC溶出,也要求时间轴上和原研一致。这是因为SNAC时间轴上和药物的溶出,对药物吸收有影响的(FDA Rybelsus Generic Guidance)。所以,想开发口服司美格鲁肽的仿制药,且又不侵权原创制剂专利,存在着上述多项具有挑战性的困难。
图1. Rybelsus在FDA网上的专利信息
商业化的考量也和IP、临床开发息息相关。口服大分子现在一个主要的弱点是生物利用度低。比如Rybelsus只有0.5-1%。商业化需要考量不同国家地域的临床需求,医疗保险,患者消费水平等。还是以Rybelsus为例,其化合物专利2026年到期或者可能更早(华东医药成功在2022年无效了该专利,现在诺和诺德上诉中)。可以预见的是,不久将来,Ozempic注射制剂仿制药上市后,无论中美,价格将大幅下降。特别在中国,内卷预期会更甚。可是口服生物利用度低,全合成或半合成的多肽药物原料成本,预期很难降到小分子化药的水平,所以口服制剂的终端价格可能会比较难和注射类的仿制药竞争。当然,在糖尿病患者中,会有部分病人对注射有抵触甚至恐惧心理,会选择口服制剂,口服在价格上有一定空间调整。虽然现在Rybelsus的年销售总额只有Ozempic销售总额的1/5(1)。但是Rybelsus上市较晚,新药推广又受到新冠影响,其上升空间可能较大。另外一个更大的潜在市场是肥胖管理,特别在中国,口服制剂对肥胖人群的市场空间较大。注射类,不仅仅是依从性比较低,对肥胖人群来说,他们理念上更多的可能是一种消费。带有针头的注射类药物,自己认为或被认为是治疗疾病,所以口服制剂预期会主导肥胖市场。
总之,口服大分子的技术研发,临床开发,专利策略,临床价值和需求的定位,商业化的布局,都是环环相扣,息息相关的。
同样的,现在拥有处于临床开发阶段的新GLP-1药物的诸多企业也必须进行类似的考量。因为一旦司美格鲁肽注射剂仿制药的上市,价格会大幅度下降。而司美格鲁肽在临床试验中的表现非常优秀,在同样的药理机理下,想要在临床试验中实现对司美格鲁肽药效和安全性的超越将是非常难的。因此后上市的GLP-1产品可能面临的是司美格鲁肽已经占据了大部分的市场份额,竞争难度会非常大。PD1是个典型的例子,何况其还是抗体类大分子,较长时间内还不存在仿制药的挤压现象。在糖尿病领域,也可以参考DPP4抑制剂和SGLT2抑制剂,仿制药占据了主导市场,很难有类似的新分子能在市场中再参与竞争。很多企业立项未能进行预见性的综合评估,最终放弃了诸多DPP4和SGLT抑制剂的临床项目,造成了资源的极大浪费。
3.小分子GLP-1 RA 的竞争考量
大分子口服的弱点,如Rybelsus生物利用度低,PK变异性高,受食物影响较大,不少企业捷足先登,开始布局创新性的小分子GLP-1 RA研发。其中辉瑞、礼来等企业项目,已经在中、后期的临床开发阶段。这些项目确实给现在口服GLP-RA造成潜在的有力竞争。但就小分子GLP-1 RA,笔者根据现公共数据,进行了深入的分析其潜力和可能存在的问题,尽可能准确和定量的评估这些潜在的竞争,帮助企业在大分子口服的立项和推进过程中,做出合适和及时的决定。当然,口服大分子技术,不仅仅局限于GLP-1药物的竞争,其可应用到其他靶点的多肽。我们在另外的撰文(
从定量药理学评估小分子GLP-1 RA 成药的可行性和方向)中从定量药理学(受体药理、临床药理、临床药效/副作用)评估了小分子GLP-1 RA 成药的可行性和方向。
4.展望未来
胰岛素发现一个世纪以来,口服大分子一直是医药工作者努力攻克的课题。口服GLP-RA成功,是从零到一的突破,是了不起的成就。这当中诸多学术科学家和工业界科学家付出的很大的努力。和很多新药研发一样,其中也经历了很多的挑战和失败(包括最近Oramed口服胰岛素三期失败)。现在大分子口服的技术缺陷也非常明显。下面是笔者对口服大分子发展的一些未来展望。
以技术为本, 做真正的创新:医药行业需要更有耐心,对科学研究,包括基础研究的重视。mRNA的递送是创新和坚持的很好例子。口服大分子,还需对基础学科,如膜科学的更深研究。真正技术创新也规避IP侵权问题,在行业中形成良性的竞争和合作。
以临床和商业价值为导向:这种价值导向的评估, 需要考虑时间轴维度。如在考量口服GLP-1 RA,除了开发更好的技术,是否考虑临床价值更加大、创新更强的项目。肠道激素类开发和商业化的历史也就10余年左右时间,已经根本性的改变了糖尿病和肥胖管理的治疗手段,包括从短效的GLP-1 RA 多肽,到长效的GLP-1 RA, 从单靶点到多靶点。
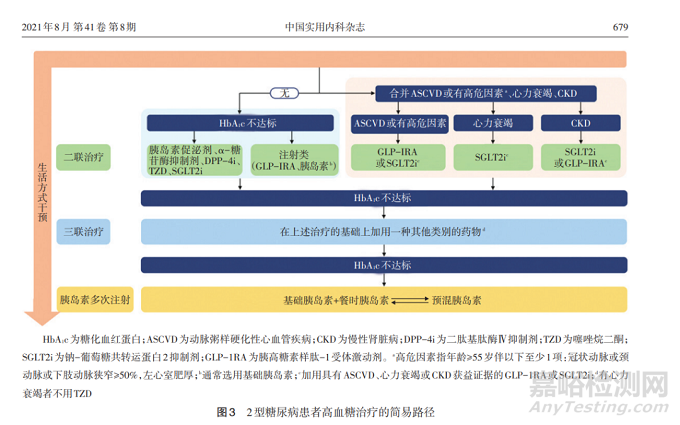
从注射到口服,我们认为现在再开发GLP-1 RA 类似的新分子的临床和商业的意义都非常有限, 除非从临床效果或者原料成本上具较大优势。企业应该更侧重于价值大的项目。比如,GLP-1 RA 和SGLT2i组合。或者新的潜力靶点,如Amylin,PYY,等。例如,礼来的双靶点激动剂tirzepatide展示了优秀的临床表现以及令人畅想的市场价值。诺和诺德 的Amylin/GLP-1组合,信达的GLP-1/GCGR双靶点,在二期临床上也有不俗的表现。特别是GLP-1和SGLT2i的组合用,其临床价值大。二者的机理不一样,但在降糖、减重,尤其是心血管收益方面,有大量的临床数据支持二者可以产生叠加或协同作用(18, 19, 20, 21)。目前,全球医学界几乎一致性的在2型糖尿病的指南里,因SGLT2或GLP-1药物的降体重和心血管受益,都将它们列为了二甲双胍控糖不足以后的主要推荐药物(图2,图3)。考虑这两类药物的协同效应,如果实现经济上可接受的GLP-1RA和SGLT2i复方,使得病人第一时间在二甲双胍控糖不足时,就能同时获益GLP-1和SGLT2二种不同而且有叠加/协调功能的治疗手段, 将为2型糖尿病的治疗带来巨大的价值。
其实,大分子口服,远不局限于GLP-1 RA。最近Oramed口服胰岛素三期失败,并不代表着方向性的错误。这当中,技术可能还没有到位,临床设计也没有导向口服胰岛素应该所对应的药理价值。其二期临床有限的数据,没有量效关系, 甚至是反向的趋势,暗示着口服吸收存在一定问题。更重要的是,口服胰岛素,其背后的药理应该是优于注射胰岛素的,因为口服胰岛素模拟着人体胰岛素的分泌,其到达的第一调节器官是肝脏。所以,是否应该完全按照注射胰岛素的临床设计,包括病人入组、临床目的、临床终点等,是应该好好思考和探索的。比如,口服胰岛素,是具有改变疾病进展或预防疾病的潜力,按照注射胰岛素降血糖的主要药理(如增强血糖在肌肉的吸收来到达降糖目的)来进行临床设计和系统血糖作为终点,是值得推敲和商榷的。一是此类机制会造成低血糖风险, 二是带来体重增加的副作用,等。不妨可以考虑,如何在糖尿病的发展初期,口服胰岛素将会减轻人体胰岛的被动调节的负担,从而逐步恢复胰岛功能。基于这类的假设,那从入组病人,临床设计等,就会不同,其临床意义也不同。
这样的例子也可以延申到其他分子和治疗领域,如,口服人生长激素。现在的医药研发方向,几乎都是往长效走。其临床药理目的是延长激素的PK, 从而增强药效。但是,这种药理,是和人体的生长激素功能是背道而驰的。人生长激素的调节分泌,是脉冲型的,即在人睡眠是调节分泌,而在其他时间是一种低维持的状态。长效生长激素,医学界一直有担心和争议的是,是否会造成潜在的副作用,包括致癌风险(22)。只是现在的临床设计和终点上,无法评估此类风险。相反,如果口服生长激素,在睡眠前服用,模拟人的正常的生理分泌功能,从药效(如增高)上预期也能达到相似的药效,但这些都没有系统研究过。所以,口服生长激素,不仅仅是带来依从性的益处,更重要的是降低了潜在的其他医学风险。
口服大分子的可能和实现,笔者相信,将进一步拓宽医药的研发和商业化的思路,最终的给患者带来更大意义的临床价值。
图2.美国糖尿病学会(ADA)发布的《ADA糖尿病医学诊疗标准(2022版)》截图
图3. 2型糖尿病患者高血糖治疗的简易路径,源自中国2型糖尿病防治指南(2020年版)
本文作者来自广州大洲生物的研发团队,包括Steve Dinh博士和唐华东博士。Steve Dinh博士曾是Emisphere的高管。在Emisphere期间,他组建了世界一流的团队,使用一系列技术开发和商业化创新医药产品。他同时帮助扩展了Eligen技术,并用12种药物的临床研究和60种药物的非临床研究证明了技术的先进性和重要性。他还曾在Noven Pharmaceuticasl(专注透皮)和CutisPharma(专注口服液)担任CSO。在医药产业和科学界,具有较高声望,是美国药物科学家协会(American Association of Pharmaceutical Scientists) 和美国医学与生物工程学会(American Institute for Medical and Biological Engineeing) fellow。唐博士的专长是PK/PD,他曾在惠氏制药、默沙东等大药企任职十余年,后创立了广州大洲生物医药。在糖尿病、帕金森、阿尔茨海默病等方向,特别是在临床转化和定量药理领域,以及和FDA药监部门的沟通交流,具丰富的研发经验。
参考文献:
1.Novo Nordisk Annual Report 2022. https://www.novonordisk.com/content/dam/nncorp/global/en/investors/irmaterial/annual_report/2023/novo-nordisk-annual-report-2022.pdf
2.Brown. Et al. Materials for oral delivery of proteins and peptides. Nature Reviews Materials. 2020, 5(2): 127~148.
3.Quangang Zhu. Et al. Oral delivery of proteins and peptides: Challenges, status quo and future perspectives. 2021, 11(8); 2416~2448.
4.MYCAPSSA FDA label. https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/208232s000lbl.pdf
5.RYBELSUS FDA label. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/213051s000lbl.pdf
6.Earvin Liang. Et al. Use of a pH-sensitive fluorescent probe for measuring intracellular pH of Caco-2 cells. International Journal of Pharmaceutics. 2007, 338: 104~109.
7.Sam J. Milstein. Et al. Oral drug delivery compositions and methods. US5766633.
8.M. A. Karsdal. Et al. The effect of oral salmon calcitonin delivered with 5-CNAC on bone and cartilage degradation in osteoarthritic patients: a 14-day randomized study. Osteoarthritis Cartilage. 2010, 18(2): 150~159.
9.Christoph Kapitza. Et al. Oral insulin: A comparison with subcutaneous regular human insulin in patients with type 2 diabetes. Diabetes Care. 2010, 33(6): 1288~1290.
10.Nagavendra Kommineni. Et al. SNAC for enhanced oral bioavailability: An updated review. 2022.
11. Xuan Ding. Et al. Oral absorption enhancement of cromolyn sodium through noncovalent complexation. Pharmaceutical Research. 2004, 21(12): 2196~2206.
12.Ehud Arbit. Et al. Oral heparin: status review. Thrombosis Journal. 2006, 4:6.
13.FDA Rybelsus Clinical Pharmacology Review(s), https://www.accessdata.fda.gov/drugsatfda_docs/nda/2020/213182Orig1s000ClinPharmR.pdf
14. S.D. Berkowitz, V. J. Marder, G. Kosutic and R. A. Baughman. Oral heparin administration with a novel drug delivery agent (SNAC) in healthy volunteers and patients undergoing elective total hip arthroplasty. Journal of Thrombosis and Haemostasis. 2003, 1:191~1919.
15. Shaker A. Mousa, Fuming Zhang, Ahmad Aljada, Seema Chaturvedi, Majde Takieddin, Haifeng Zhang, Lianli Chi, M. Cristina Castelli, Kristen Friedman, Michael M. Goldberg, Robert J. Linhardt. Journal of Clinical Pharmacology, 2007, 47:1508~1520.
16.专利“包含GLP-1激动剂和N-(8-(2-羟基苯甲酰氨基)辛酸盐的固体组合物”,申请号201610420028.X。
17. 国家食品药品监督管理总局. 利拉鲁肽注射液生物类似药临床试验设计指导原则
18. Robert S. Busch, Michael P. Kane. Combination SGLT2 inhibitor and GLP-1 receptor agonist therapy: a complementary approach to the treatment of type-2 diabetes. Postgraduate Medicine. 2017, 129, 7, 686-697.
19. Ralph A. DeFronzo, Combination Therapy with GLP-1 receptor agonist and SGLT2 inhibitor. Diabetes Obes. Metab. 2017, 19(10):1353~1362.
20. Edison Goncalves, David S. H. Bell. Combination Treatment of SGLT2 inhibitor and GLP-1 receptor agonist: Symbiotic effects on metabolism and cardiorenal risk. Diabetes Ther. 2018, 9: 919~926.
21. Bernhard Ludvik, Juan P Frias, Francisco J Tinahones, Julio Wainstein, Honghua Jiang, Kenneth E Robertson, Luis-Emilio Garcia-Perez, D Bradley Woodward, Zvonko Milicevic. The Lancet. 2018, 6(5): 370-381.
22. Stefano Cianfarani. Risk of cancer in patients treated with recombinant human growth hormone in childhood. Ann. Pediatr. Endocrinol. Metab. 2019, 24: 92~98.