您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-14 15:53
前言:“利托那韦(Ritonavir)”事件是“消失多晶型”的典型案例,“消失的晶型Form I”导致其上市不到2年而被迫撤市,这让原研雅培公司一度限于舆论危机,导致经济损失超过2.5亿美元。虽然利托那韦事件是“臭名昭著”的负性事件,但科学家在一年内解决上述问题,将药物重新推向市场,其系统的研究策略值得我们借鉴。
1 消失的多晶型事件回顾
1995年12月,利托那韦NDA新药申请;
1996年01月,雅培(Abbott)开始商业批生产;
1996年03月,FDA批准上市,用于治疗艾滋(AIDS获得性免疫缺陷综合征);
1998年初,部分制剂生产工厂出现API“溶解问题”,溶解性变差是由于生产的API晶型变成了利托那韦的另一种更稳定的晶型Form II。随后几乎所有的生产工厂及实验室,均无法得到满足溶解性要求Form I晶型,直接导致制剂“无米下锅”,药物产品无法继续上市供应,利托那韦被迫撤市。
2 Form II 哪来的?
“知来处,方知归处”!知道Form II哪来的?才能有的放矢的对付他。雅培的科学家们做了大量的统计分析工作,考察任何可能导致Form II产生因素(总杂、单杂、未知杂质、PH、无定形的含量、洗涤条件等),但失败了!科学家们未找到任何导致稳定晶型Form II产生的确切原因。
由于利托那韦以固体形式给药,几乎没有生物利用度,因此之前上市药物产品的两种剂型中(半固体软胶囊和液体制剂),API均是溶解成溶液状态。公知常识,只要固体溶解,化合物的性质将不受晶型的影响。从这个角度上来讲,只要制剂工艺能保证利托那韦API的完全溶解,利托那韦的两种晶型(Form I和Form II)理论上均可以用于制剂开发。无法找到产生Form II的原因,外加Form II是更稳定的晶型,无转晶的风险,似乎开发Form II晶型的制剂重回市场更有利(如盐酸雷尼替丁放大研究中Form I消失后,后续直接开发更稳定的Form II上市)。
3 谨慎对待:“双保险”策略
遭遇突发撤市事件的雅培,谨慎的选择了“双保险”的研究策略,两种方案同时展开研究:
方案一:选择更稳定的晶型Form II作为制剂晶型开发上市,需要解决的问题是:a. 重新开发制剂工艺,即开发新制剂处方确保FormII的完全溶解。b. 生产制备Form II。
方案二:继续选择亚稳晶型Form I作为制剂晶型上市,另一部分研究者集中解决的问题:重新开发API结晶工艺,即保证能生产出高纯度的FormI晶型;然后接着按以前的制剂处方溶解API后上市。
介稳晶型Form I和稳定晶型Form II 在制剂“溶解基乙醇-水”中的溶解度如下表1所列,改变乙醇/水配比以及增加溶解基均能增加Form II的溶解量。液体制剂开发新制剂处方没有太高的技术壁垒。因此方案一和方案二技术问题本质上均落在了原料端,即“目标晶型制备”。
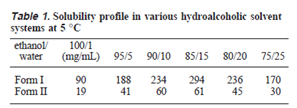
在当时的情形下,Form I在制剂中转晶风险非常高,只要有1 ppm的Form II晶种,Form I就会很快消失。很显然Form II更易得。方案一选择更稳定的Form II晶型似乎是重回市场最理想的“路”。
4 依然选择“介稳晶型”重回市场
但很快,实践的数据给出了答案:“科学研究没有捷径”。重结晶制备Form II的过程中,有高达50%的失败率,失败的原因不是晶型问题,而是溶剂残留和杂质超标问题。通过在碱液洗涤步骤和延长烘料时间(增加时间成本),可以解决溶剂残留和大部分杂质超标问题。但有一个前体杂质(氨基甲酸酯杂质)是起始物料中带来的杂质,大量实验结果表明,该前体杂质总是跟随Form II一起析出,导致成品中该杂质超标。唯有在起始物料中控制前体杂质的带入量,才能得到合格的Form II原料药。
与此同时,放案二(消失的介稳晶型FormI制备)的研究团队经过大量试验,得到几条“利好”的结论:(1)Form II经过超声溶解后,重结晶制备得到Form I,证明了溶液中的Form II没有“记忆功能”,找回消失的“晶型I”技术可行;(2)总“阴魂不散”伴随着Form II 析出的前体杂质不会随着Form I析出,而是留在母液中(当时还不清楚是什么原因)。(3)利托那韦从开发直至上市,仅存在一种晶型(Form I),原料药的Form I的长期化学稳定性及晶型稳定性均满足制剂要求;(4)Form I 是介稳晶型,在制剂溶剂基中溶解速度快,相比Form II显著缩短制剂工艺时间。
选择哪种晶型用于制剂开发,绝不是简单粗暴的铁律“最稳定的晶型用于制剂开发”。需要结合制剂工艺、给药途径、工艺可行性、成本等综合评估。虽然“利托那韦制剂”对晶型没有特殊要求,公司也开发出了符合稳定晶型Form II的制剂配方。但Abbort从“原料生产和制剂生产”的角度考虑,仍然选择了“介稳的Form I”作为API的晶型重回市场。
5 “反滴法”制备介稳晶型成为“经典方法”
雅培科学家在制备Form I过程中,从介稳晶型制备的常识出发,确定方向是“高过饱和度条件下加大量的介稳晶型的晶种”,初期开发的方法中,Form I晶种量高达50%,高晶种量最大的问题就是批收率直接降低50%。后期优化结晶工艺时,创造性的开发了“反滴法”并成功放大生产。“反滴法”即少量的晶种(0.5%)加入到一定量的反溶剂中悬浮,API的溶液缓慢滴加至“有晶种悬浮的反溶剂中”,因为滴加的溶液量很少,析晶时达到了“高晶种量”的效果。
虽然Ritonavir在1999年重回市场,但晶型的研究依然在深入,研究者通过单晶数据得到利托那韦Form I和Form II是构象多晶型,并且通过计算和实验方法证明,Form I是动力学优势“构象”,总是会优先析出。Form II的出现是由于某种“杂质”和Form II有相同的构象,充当了Form II的“异源构象晶种”,这也可能是Form II重结晶中总有前体杂质(与Form II具有相同的构象)伴随析出的原因。对于构象多晶型,优势的构象(Form I)结晶也许不需要采用“高过饱和度+极大量的晶种”的方法,但雅培开发的“反滴法”方法却已深入人心,成为制备介稳晶型的经典。
结束语:这是雅培公司对利托那韦晶型事件的总结,翻译传达不够精确,直接上原文:“Dealing with Polymorphsis Potentially Precarious Practice and the Properway to Play this game is with Patience and Perseverance.”
参考文献:
[1] Chemburkar S R ,Bauer J , Deming K , et al. Dealing with the Impact of Ritonavir Polymorphs onthe Late Stages of Bulk Drug Process Development[J]. Org.proc.res.dev, 2000,4(5):413-417.
[2] Dejan‐Krešimir Bučar, Lancaster RW , Bernstein J . Disappearing Polymorphs Revisited[J]. Angewandte ChemieInternational Edition, 2014.
[3] J. Bauer, S. Spanton, R. Henry, J.Quick, W. Dziki, W. Porter, J.Morris, Pharm. Res. 2001, 18, 859–866。

来源:药事纵横


