您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-07-07 19:33
MDR (EU) 2017/745法规第27条和IVDR (EU) 2017/746法规第24条均对UDI做出了规定:
01、UDI由UDI-DI(器械标识符)和UDI-PI(生产标识符)组成;
02、UDI 应使用于器械的标签或其包装上,或者可重复使用器械本身(直接标记);
03、经济经营者,卫生机构和卫生保健专业人员分别根据本细则第8和9款规定的条件存储UDI;
04、根据MDR第28条和IVDR第25条,为唯一器械标识建立UDI电子系统(“ UDI数据库”),该数据库是Eudamed数据库的一部分;
UDI是什么?
UDI(Unique Device Identification)医疗器械唯一标识,是通过全球公认的器械标识和编码标准创建的一系列数字、字母或字符。它可以明确地识别市场上的医疗器械。
UDI由UDI-DI(器械标识符)和UDI-PI(生产标识符)组成,它可以包括有关批号或序列号的信息,并且可以在世界任何地方使用。
UDI-DI是特定于某一制造商和器械的UDI器械标识符,提供附件VI 第B部分所述信息访问途径。
UDI-PI用于标识所生产的器械单元以及附录VI 第C 部分中包装后的器械(若适用)。
什么是Basic UDI-DI?
Basic UDI-DI是访问Eudamed数据库中器械相关信息时的关键词,也是相关文档[例如,证书(包括自由销售证书),欧盟符合性声明,技术文档以及安全和(临床)性能摘要)]中的关键信息。
它旨在识别和连接具有相同预期用途,风险等级以及基本设计和制造特征的器械。
它独立于/独立于器械的包装/标签,并且没有出现在任何贸易商品上。
任何Basic UDI-DI均应以唯一的方式标识该Basic UDI-DI涵盖的器械(组)。
区别
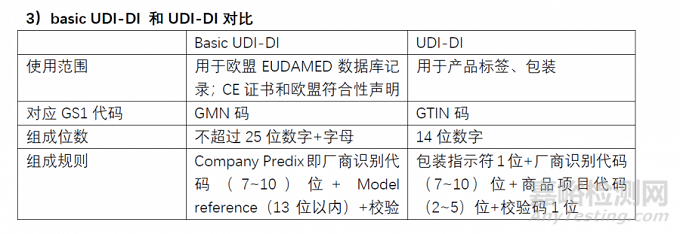
如何准备Basic DUI-DI
Basic UDI-DI是在医疗器械的一个器械组层面上分配DI并完成赋码,这个和原来UDI-DI需要针对每一组别产品中的每个规格,每个包装规格分别赋码是不同的。
Basic UDI-DI是EUDAMED数据库中关键信息,同时会体现在CE证书、欧盟符合性声明和技术文件中。
Basic UDI-DI的结构
Basic UDI-DI是由Company Prefix + Model Reference+校验码组成,长度不能超过25位。
Company Prefix即厂商识别代码,与UDI中的一致,由 GS1 分配
Model Reference,也就是产品识别代码,是由企业自行编制, 可由字母和数字组成,比如口罩产品即可命名MASK001,或直接 MASK也可以。
校验码:直接在 GS1 网站输入company prefix 和 Model Reference 信息,在线生成校验码检验网址:https://www.gs1.org/services/gmn-generator
结束语
欧盟的Basic UDI-DI是欧盟医疗器械法规中的一个概念,是器械类型的主要识别符,该代码与UDI-DI不同。UDI-DI跟着产品走,体现在产品、包装和标签上,实现的是产品追溯目的;
而Basic UDI-DI跟着文件走,体现在证书、符合性声明和技术文件中,实现的是文件对应的产品组的识别。
Basic UDI-DI的要求已经于2021年5月26日开始生效,广大制造商需要尽快申请编码并纳入自身的MDR文件体系。

来源:微珂器械服务


