您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-19 15:10
近期,东华大学王璐教授、王富军教授和上海交通大学附属新华医院孙锟院长在科爱出版创办的期刊Bioactive Materials上发表研究论文:机械自增强型复合结构可降解血管支架。本研究采用聚合物丝线经编织和热处理技术,开发了一种复合结构可降解血管支架。基于相关表征分析和动物实验观察,证实其具有优异的机械支撑性能、顺应性和生物相容性。
研究内容简介
可降解血管支架由于安全的降解性能使其成为治疗小儿先天性血管狭窄性疾病潜在的治疗手段和方法。但目前可降解支架的研制多集中在冠状动脉狭窄性疾病治疗上,支架直径小于4 mm,而针对直径为6-9 mm婴幼儿大动脉的可降解血管支架研制报道甚少;且聚合物可降解血管支架存在着径向支撑性能不足,降解时间与血管修复愈合时间不匹配等问题,限制了其临床应用和发展。因此,需要设计一种面向先天性血管狭窄性疾病患者的聚合物可降解血管支架,具有力学增强性能和适宜的降解性能,以改善现有可降解血管支架的问题。
基于上述需求,本研究开发了一种具有机械自增强性能的PCL/PPDO复合结构可降解血管支架。该复合结构血管支架由PPDO单丝和PCL/PPDO皮芯结构复合纱线编织而成,并利用材料熔点差异经热处理将PCL组分熔融-固化后在部分交织点形成稳定粘结,从而显著增强了编织支架的力学性能。此外,该复合结构支架具有优异的顺应性。通过改变两种组分的配比,可以制备出具有不同力学性能的复合结构支架,为临床上个性化定制血管支架的开发提供了可能。动物实验结果表明,该复合结构血管支架具有与金属支架Wallstent相当的机械支撑性能。植入到猪髂动脉和腹主动脉后一个月内复合结构支架均实现完全的内皮化,并在植入12个月内保持管腔通畅。
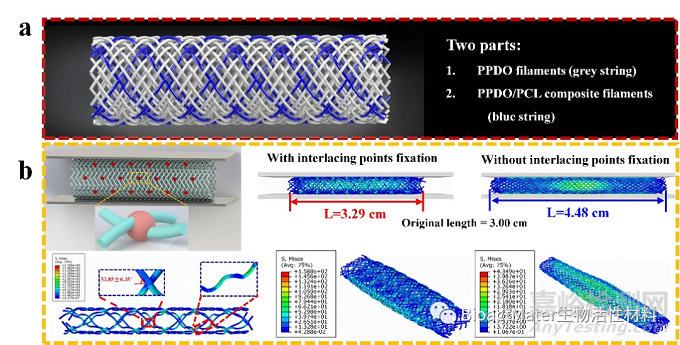
图1 PCL/PPDO复合结构血管支架的示意图和有限元分析
我们首先采用Abaqus软件构建了编织结构血管支架的有限元模型,通过对部分交织点进行固定,探究了不同支架模型的应力应变分布情况和支架模型在受到平板压缩外力作用下的表观形态变化,并进一步提出了本研究期望开发的具有机械自增强型的编织支架结构模型。有限元分析结果表明,通过对部分交织点规律性固定,可以减少丝线之间的滑移,增加丝线的弯曲变形并产生较大的应力分布,从而可有效提高支架的力学支撑性能。
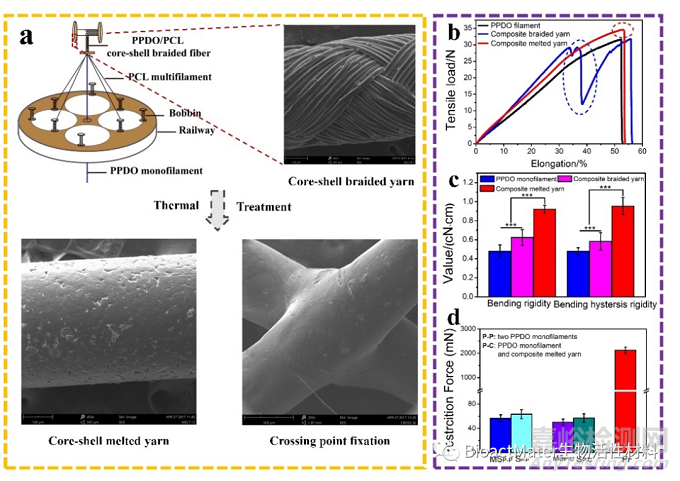
图2 PCL/PPDO皮-芯结构编织纱线的制备和性能评价
在明晰了限制交织点的滑移和转动是提高支架力学性能的有效途径以后,本研究设计制备了一种以PPDO单丝为芯,PCL复丝外包的皮芯结构编织纱。通过二维编织机,将 PPDO 单丝与PCL复丝复合,制备皮芯结构编织纱,优化制备参数,最终获得编织角为 78.12 ± 6.21°的PCL/PPDO编织纱,可以实现PCL复丝对PPDO单丝的完全包覆。随后利用两种材料的熔点差异,通过热处理技术皮层软化熔融,在芯层表面流动铺展,可以得到皮芯结构熔融纱线,并在两根交织的复合纱线之间形成机械粘结固定。单轴拉伸曲线结果表明,通过将皮芯结构编织纱经过90℃热处理后可以实现皮层与芯层的牢固结合。相对受到表面摩擦力束缚的普通交织纱线来说,粘结固定后的交织点具有较高的剥离强力,从而可以抵抗丝线在外力作用下发生滑移。
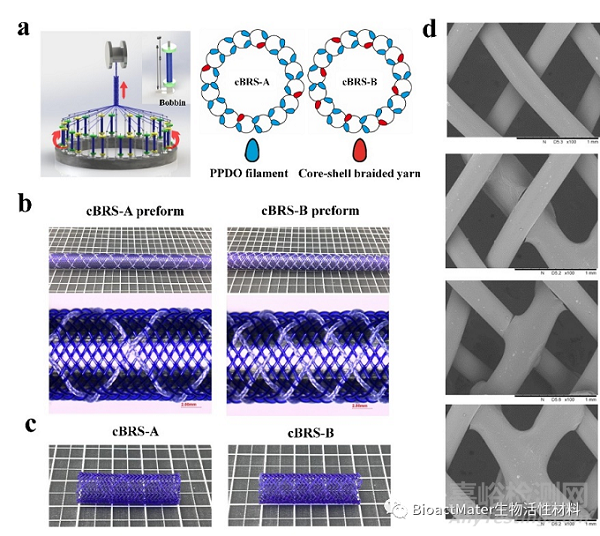
图3 PCL/PPDO复合结构血管支架的制备与成型
随后,本研究将皮芯结构编织纱线与PPDO单丝以两种配比和排列方式经32锭二维编织机制备得到 PPDO/PCL编织自增强型血管支架胚管,然后经过90℃热定型处理1小时,得到结构稳定的 PPDO/PCL编织自增强型血管支架,支架中纱线之间存在四种交织形式,部分交织点实现了粘结固定。
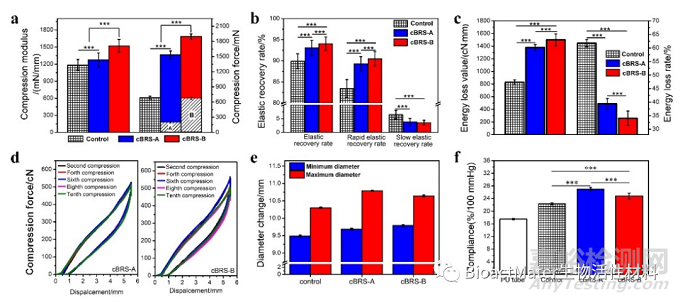
图4 PCL/PPDO复合结构血管支架的体外力学性能评价
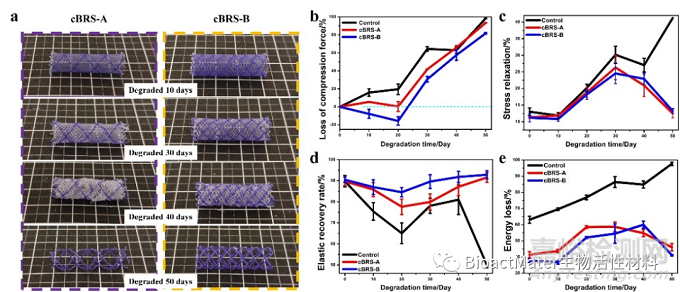
图5 PCL/PPDO复合结构血管支架的体外降解性能评价
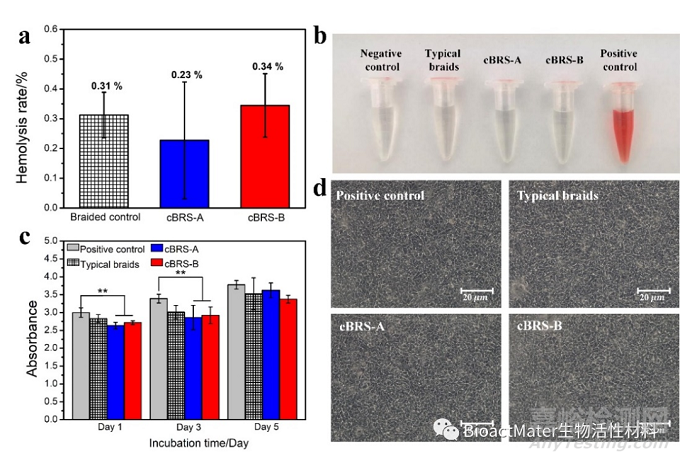
图6 PCL/PPDO复合结构血管支架的体外生物相容性评价
体外的力学性能测试、降解性能测试和细胞与血液相容性测试结果表明,复合结构血管支架兼具优异的机械支撑性能和顺应性、两级梯度降解性能(降解过程中支架结构稳定)、以及良好的生物相容性。
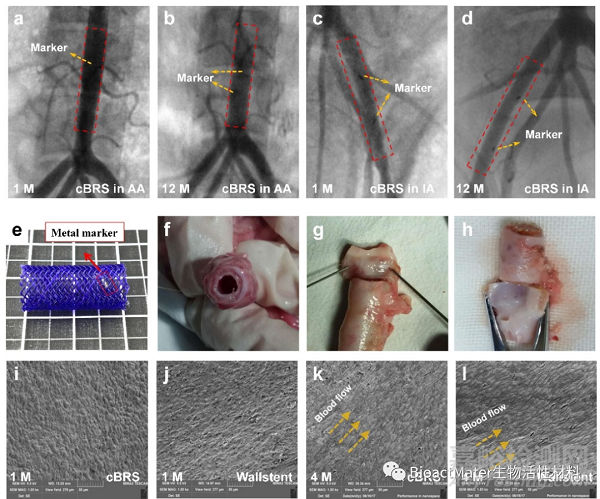
图7 PCL/PPDO复合结构血管支架的体内植入与观察
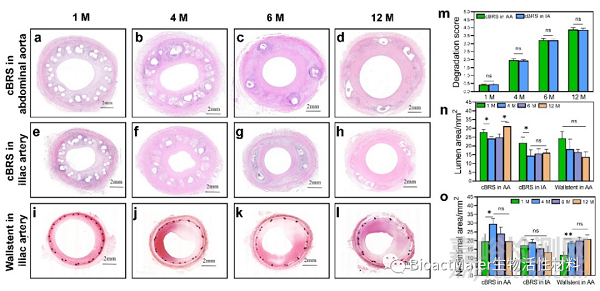
图8 PCL/PPDO复合结构血管支架的体内生物学评价-1
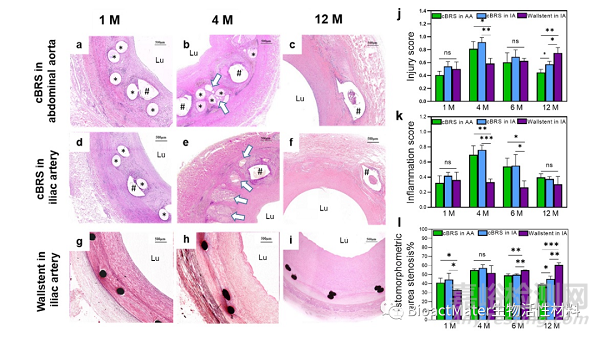
图9 PCL/PPDO复合结构血管支架的体内生物学评价-2
由于cBRS-A具有更加优异的顺应性,因此本研究将cBRS-A复合结构支架分别植入到猪的腹主动脉和髂动脉血管中进行动物实验研究。不同时期的血管造影结果表明,所有支架在植入后12个月内均保持支架植入段管腔的通畅。支架植入段血管在术后一个月内发生管腔扩张,12个月时复合结构支架植入段血管的管腔面积与正常血管相比类似,仅发生4.60±4.23%和11.44±3.70%的损失,而在对照组金属支架(Wallstent)植入后12个月,血管管腔损失率达到了22.54±4.13%。根据SEM结果,支架植入后一个月内即发生内皮细胞在支架内壁上的完全覆盖,并在4个月时内皮细胞随血流方向排列。这表明复合结构支架具有低血栓发生风险和良好的生物相容性。对cBRS explants进行总体形态评估,结果表明1个月后管腔中有新组织形成,并在新组织和cBRS之间观察到明显的边界,表明新组织在支架表面生长并将支架包覆在组织中。支架植入后4个月,PPDO单丝发生明显降解并被蛋白聚糖基质替代。支架植入后6个月,PPDO几乎降解完全,并被结缔组织替代。而PCL/PPDO复合纱线在这段时间内没有明显的降解痕迹,纱线边界清晰可见。复合结构支架植入后的腹主动脉管腔面积从1个月的27.90±1.50 mm2减少至4个月的24.20±1.00 mm2,但此后管腔增加,这可能是由于PPDO成分在植入4个月后被吸收所致。在12个月内观察到明显更大的管腔面积(31.20±2.20 mm2),这表明cBRS的降解过程对血管愈合过程的影响较小。与此相反,Wallstent支架髂动脉植入后管腔面积在12个月的随访中持续下降,在12个月时仅为13.70±2.80 mm2。通过对血管损伤程度进行评分,发现4个月时血管的损伤程度最大(0.81±0.11-腹主动脉,0.92±0.07-髂动脉),而在12个月时,损伤评分下降到0.44±0.05(腹主动脉)和0.57±0.05(髂动脉),且明显低于Wallstent植入段血管的损伤程度(0.75±0.08)。本研究还对支架置入后血管的炎症反应程度进行了分析。在复合结构支架植入后1个月、4个月、6个月和12个月仅表现出轻微的炎症反应,与Wallstent支架植入段血管的炎症反应类似,没有观察到组织坏死的现象。在复合结构支架植入后4个月,吞噬细胞聚集在支架附近并逐渐吞噬支架降解碎片。通过对炎症反应程度进行评分,发现由于降解碎片的产生,炎症反应程度在4个月时最大(腹主动脉:0.70±0.12,髂动脉:0.76±0.07),而在12个月时,复合结构支架的炎症反应评分下降到0.40±0.05(腹主动脉)和0.38±0.03(髂动脉),与Wallstent支架植入后的炎症反应评分类似(0.31±0.10)。通过对血管管腔的再狭窄进行组织学分析发现,尽管在复合结构支架植入后1个月时,其再狭窄率高于Wallstent,但是在4个月时两者再狭窄程度相当,并在12个月时复合结构支架植入后的再狭窄程度显著下降,并且显著低于Wallstent支架的再狭窄程度。
此外,本研究的另一个重要部分是分析不同支架—血管直径比对支架植入后的降解性能的影响。本课题前期体外研究结果表明,外力作用下会改变可降解聚合物支架的降解行为。与未受到载荷作用的支架相比,当可降解血管支架受到血流脉动压力作用时,血管壁的径向力会加速支架表面的降解。同时,目前就针对主动脉的可降解聚合物基血管支架,支架与目标血管的直径比尚无明确标准。因此,在本研究中,我们选择了两个不同直径的血管进行支架植入(腹主动脉和髂动脉),植入的腹主动脉和髂动脉的直径分别为7.12±0.21mm和5.16±0.11mm,获得的支架与动脉的比率为1.13±0.03和1.55±0.03。体内降解研究表明,cBRS的PPDO单丝和PCL/PPDO复合纱线在植入1个月后仍保持横截面完整性,并且在4个月的随访中PPDO单丝被降解,这个结果与体外cBRS的降解速率一致。此外,PPDO组分降解为大量的碎片,并且在6个月后该区域被蛋白聚糖基质所取代。该降解过程比体外预测时间更早发生。研究表明,巨噬细胞中的溶酶体有助于消除可生物吸收的聚合物。据报道溶酶体的pH约为5,导致PPDO撑杆周围呈酸性环境。因此,与中性体外环境相比,体内降解过程更快。更重要的是,血流脉动压力对cBRS降解速率并没有明显的影响,这与体外的动态降解结果不同。可能的原因是支架植入后一个月即完全被内皮细胞覆盖,新生组织将支架镶嵌在组织内,减少了脉动压力的载荷作用。此外,植入腹主动脉和髂动脉的支架之间的降解评分没有显著差异,也表明外力作用对cBRS降解速率没有明显影响。
原文信息
Fan Zhao, Jing Sun, Wen Xue, Fujun Wang, Martin W. King, Chenglong Yu, Yongjie Jiao, Kun Sun, and Lu Wang.
"Development of a polycaprolactone/poly (p-dioxanone) bioresorbable stent with mechanically self-reinforced structure for congenital heart disease treatment."
Bioactive materials 6, no. 9 (2021): 2969-2982.
DOI: 10.1016/j.bioactmat.2021.02.017

来源:BioactMater生物活性材料


