您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-19 09:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
恒瑞IL-17A单抗获批临床。恒瑞医药自主研发的1类新药SHR-1314注射液获国家药监局临床试验默示许可,拟开发适应症为强直性脊柱炎。SHR-1314(Vunakizumab)是一款IL-17A靶向单抗,拟用于治疗与IL-17通路相关的自身免疫疾病。此次为该药获批的第二项临床。目前,恒瑞已针对该药展开7项临床,最高处于临床II期。目前全球已有2款IL-17A抗体获批,诺华的 secukinumab(Cosentyx)和礼来的 ixekizumab(Taltz)。这两款新药已作为第一批临床急需境外新药在中国获批上市。
国内药讯
1.南京圣和丙肝新药和乐布韦申报上市。南京圣和1类新药和乐布韦片(SH229)的上市申请获CDE受理,用于治疗慢性丙肝。和乐布韦是国内首个NS5B抑制剂,肝靶向能力强,抗病毒活性高,非临床研究数据证实,SH229对基因1-6型HCV的体外抗病毒活性为索磷布韦的2-3倍。一项Ⅱ期临床CTR20182539结果显示,SH229联合达拉他韦在1/2型HCV感染患者中的SVR12(12周病毒持续响应率)达到100%,在6型HCV感染患者中的SVR12达到93.3%。
2.默沙东抗感染新药在中国申报上市。默沙东抗病毒药物来特莫韦(letermovir)提交四项新药上市申请获CDE受理,包括注射液和片剂两种剂型。来特莫韦是一种新型非核苷CMV抑制剂(3,4-二氢喹唑啉),FDA已于2017年11月批准来特莫韦口服片剂和静脉注射液,用于接受异基因造血干细胞移植后CMV血清呈阳性的成人患者预防CMV感染和相关疾病。据悉来特莫韦是15年来在美国批准的首款治疗CMV感染新药。
3.百济神州PD-1治疗NSCLC达Ⅲ期主要终点。百济神州PD-1百泽安(替雷利珠单抗注射液)在治疗铂类化疗后疾病进展的二线或三线局部晚期或转移性非小细胞肺癌(NSCLC)的Ⅲ期试验RATIONALE 303中获积极中期结果。经DMC评估,与多西他赛相比,替雷利珠单抗在意向治疗患者中达总生存期这一主要终点指标;安全性数据与已知风险相符,未出现新的安全警示。RATIONALE 303是该新药针对NSCLC的研究中第三项在中期分析中达主要终点的Ⅲ期临床,也是该单抗临床项目中第一项取得积极结果的全球关键性临床试验。
4.英派药业Wee1抑制剂在美获批临床。英派药业Wee1抑制剂IMP7068获FDA批准,即将在美启动首个临床试验。IMP7068是英派药业自主研发并拥有全球知识产权的全新化合物,已在动物体内显示出良好的安全性、耐受性和药代动力学特征,并在多个肿瘤细胞株和动物模型中展示了很高的抗肿瘤活性。这项Ⅰ期研究旨在评价IMP7068单药在晚期实体瘤受试者的安全性、耐受性、药代动力学特征及初步疗效。
5.先声药引进品种CDK 4/6抑制剂临床获受理。CDE受理先声药业和G1 Therapeutics公司联合申报的注射用trilaciclib的临床试验申请。trilaciclib是G1公司开发的一款“first-in-class”CDK 4/6抑制剂,拟开发用于正在接受化疗治疗的小细胞肺癌(SCLC)患者,曾获FDA授予的优先审评资格和突破性疗法认定,FDA预计在明年2月15日之前做出回复。先声药业拥有该产品注射剂型在大中华地区所有适应症的开发和商业化权益。
国际药讯
1.FDA宣布披露用于支持紧急使用授权的审评信息。FDA于11月17日发布声明,宣布致力维护COVID-19紧急使用授权(EUA)的透明度。承诺当CDER 或CBER监管的产品被授权用于紧急使用、或已发布的EUA被修订或撤销时,FDA打算在适当的范围内并在法律允许下公开CDER和CBER对支持决定的科学数据和信息的审评。FDA旨在在可行的情况下公开EUA审评文件中的信息,与FDA在新药和生物制品获得批准后发布科学审评的长期做法保持一致。
2.诺和诺德索马鲁肽治疗2型糖尿病结果积极。诺和诺德评估每周一次2.0mg和1.0mg索马鲁肽(semaglutide)作为二甲双胍和/或磺酰脲类药物辅助治疗2型糖尿病的Ⅲb期临床SUSTAIN FORTE研究结果积极。在第40周时,与1.0mg semaglutide相比,2.0mg smgsemaglutide可显著降低糖化血红蛋白(HbA1c),达主要终点。两组达HbA1c控制在7.0%以下的患者比例分别为68%和58%,患者体重分别下降了6.9千克和6.0千克。两种剂量的索马鲁肽均具有良好的安全性。
3.三星Bioepis公布雷尼珠单抗Ⅲ期临床最新结果。三星Bioepis在AAO2020年会上公布了雷尼珠单抗生物类似药SB11治疗新生血管年龄相关性黄斑变性(nAMD)Ⅲ期研究最新结果。在治疗第52周,SB11治疗组最佳矫正视力相对基线的最小平方(LS)平均变化为9.79个字母,雷尼珠单抗(Lucentis)治疗组为10.41个字母(差异:-0.62[90%CI:-2.092,0.857]);SB11治疗组黄斑中心视网膜厚度相对基线的LS平均变化为-139.55μm,Lucentis组为-124.46μm(差异:-15.09[95%CI:-25.617,-4.563])。SB11与雷尼珠单抗达非疗效性标准。
4.长效HIV预防新药获FDA突破性疗法认定。FDA授予ViiV Healthcare在研长效注射型抗病毒药物卡博特韦(cabotegravir)突破性疗法认定,用于HIV暴露前预防(PrEP)治疗。在一项Ⅱb/Ⅲ期临床HPTN083中,长效卡博特韦与每日口服的PrEP片剂相比,其预防HIV感染的有效性提高66%。卡博特韦与利匹韦林(rilpivirine)构成的长效抗病毒组合疗法近日已在加拿大获批上市,患者只需每月一针,就能够有效抑制HIV-1病毒增殖。
5.罗氏与Lead Pharma开发免疫疾病创新疗法。致力于开发治疗免疫介导疾病和癌症创新疗法的Lead Pharma公司宣布,将与罗氏合作开发治疗广泛免疫介导疾病的口服小分子药物。Lead Pharma已在TH17通路中发现一个新治疗靶点,并且在临床前体外和体内模型中,以及遗传学和患者数据库中验证了它与疾病的相关性。根据协议,Lead Pharma将获得1000万欧元的预付款,总额可能总计2.6亿欧元的里程碑付款等。
6.百时美施贵宝收购MyoKardia公司。百时美施贵宝(BMS)宣布已完成对MyoKardia公司的131亿美元全现金收购。通过收购,BMS将获得MyoKardia旗下的mavacamten药物,这是一款用于治疗肥厚型梗阻性心肌病(HCM)的潜在心血管药物,基于EXPLORER-HCM研究的数据,mavacamten用于治疗阻塞性症状HCM的新药申请预计明年第一季度向FDA提交。BMS计划在其他适应症(包括非梗阻性肥厚型心肌病)中探索mavacamten的全部潜力,并开发另两款临床阶段的danicamtiv(MYK-491)和MYK-224。
医药热点
1.复旦儿科“AI医生”进入临床应用。由复旦大学附属儿科医院联合上海国际人类表型组研究院共同开发的“儿科门诊临床诊断智能决策支持系统”——“小布AI医生”启动多中心临床应用。经过近一年开发的“小布AI医生”日益完善,“内涵”占复旦儿科医院总门诊量75.59%,覆盖呼吸、消化等8个儿科专科主题、13个科室,收纳了700余万条门诊电子病历数据,总结出国家儿童医学中心宝贵临床诊疗经验。
2.部分医疗机构不再核发设置批准书。近日,国家卫健委发布《关于取消部分医疗机构〈设置医疗机构批准书〉核发加强事中事后监管工作的通知》,明确除三级医院、三级妇幼保健院、急救中心、急救站、临床检验中心、中外合资合作医疗机构、港澳台独资医疗机构外,举办其他医疗机构的,卫健行政部门不再核发《设置医疗机构批准书》,在执业登记时发放《医疗机构执业许可证》。
3.江苏省基层医生年均工资达10万。11月17日,国务院医改领导小组秘书处、国家卫健委就介绍“十三五”综合医改试点省份医改典型经验举行发布会。以江苏省为例,全省建有医联体511个,24个国家紧密型县域医共体试点县(市、区)实体化运行,并在紧密型医共体内部推行基层卫生人才“县管乡用”制度。目前,该省基层卫生人员年人均工资性收入达到10万元,其中基层卫生骨干人才达15.8万元。
股市资讯
【华神科技】公司完成了药品生产许可证变更手续,并领取了《药品生产许可证》。
【百奥泰】公司收到国家药监局核准签发的关于公司在研药品BAT1006注射液的《临床试验通知书》。
【安图生物】公司于近日收到河南省药品监督管理局颁发的《医疗器械注册证》,具体药物:甲状腺素检测试剂盒(磁微粒化学发光法),白细胞介素-6检测试剂盒(磁微粒化学发光法)。
审评动向
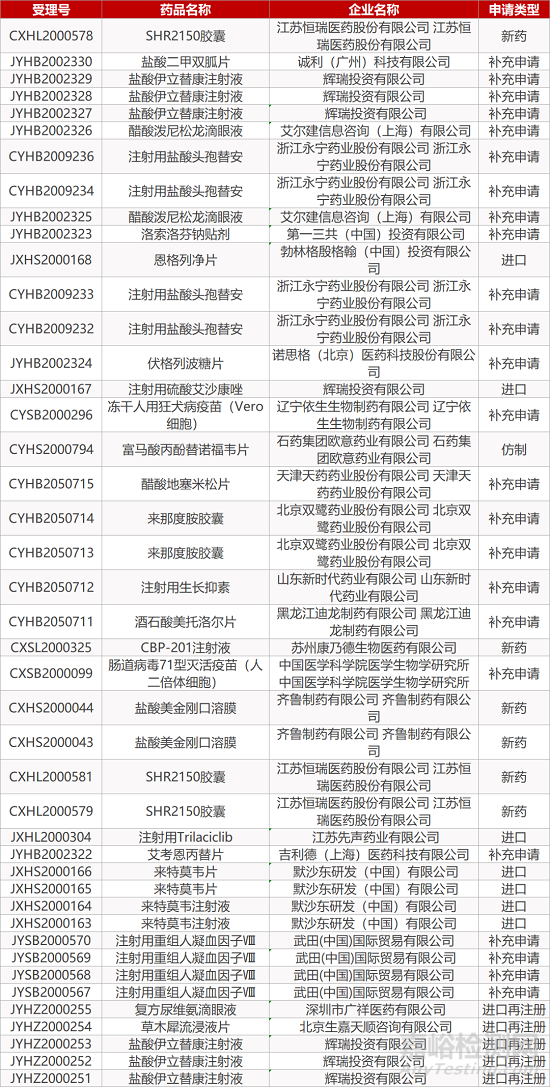
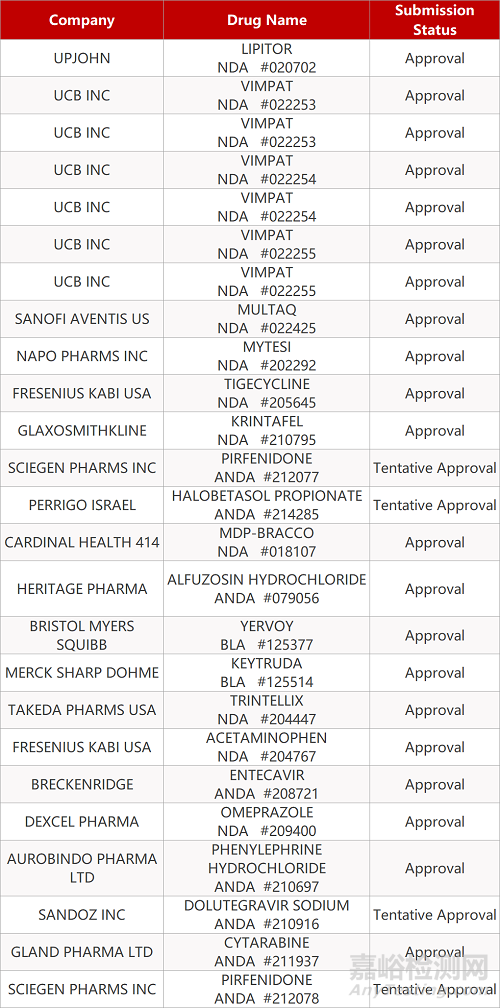
- The End -

来源:Internet


