您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-29 10:30
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
中国生物新冠灭活疫苗Ⅰ/Ⅱ期临床成功。6月28日,国药中国生物北京生物制品研究所研制的新冠病毒灭活疫苗Ⅰ/Ⅱ期临床揭盲结果积极。这是6月16日武汉生物制品研究所研制的新冠病毒灭活疫苗Ⅰ/Ⅱ期临床揭盲后,中国生物新冠灭活疫苗临床研究获得的又一重要数据。揭盲数据显示,疫苗接种后显现了良好的安全性和免疫原性,接种疫苗组受试者均产生高滴度抗体。6月23日,国药集团中国生物新冠灭活疫苗国际Ⅲ期临床在阿联酋正式启动。
国内药讯
1.李氏大药厂「普卢利沙星片」在中国获批。李氏大药厂引进品种Unidrox(普卢利沙星片)获国家药监局批准上市,用于治疗急性无并发症下泌尿道感染(单纯性膀胱炎)、并发症下泌尿道感染、慢性支气管炎急性加重或急性细菌性鼻窦炎患者。普卢利沙星是一款由日本新药株式会社研发的口服喹诺酮抗菌剂,于2002年12月起在日本推出。2009年,李氏大药厂与日本新药达成了在中国销售含有普卢利沙星的药品的专营权许可协议。
2.齐鲁甲磺酸雷沙吉兰片首仿即将获批。齐鲁制药甲磺酸雷沙吉兰片4类仿制药的上市申请变更为"在审批",预计近期获批上市,成为该品种首家获批的国内仿制药。甲磺酸雷沙吉兰片(安齐来)是由灵北公司和Teva共同开发的帕金森病治疗药物,属于第二代MAO-B抑制剂。该原研药于2005年2月和2006年5月分别在欧盟和美国获批上市,2017年6月获批进口中国。目前,只有齐鲁和常州四药两家产品按4类申报。
3.罗氏IL-6R单抗在华上市申请拟纳入优先审评。6月24日,罗氏在中国提交的视神经脊髓炎谱系疾病(NMOSD)新药satralizumab上市申请获CDE纳入拟优先审评公示名单。Satralizumab是一种IL-6R单抗,通过阻断IL-6信号转导,调节NMOSD疾病发生的多个环节,如抑制NMOSD特异性抗体AQP4-IgG的产生及中枢神经系统内外的炎症反应等。罗氏已在美国、中国和欧盟等全球十多个国家及地区递交了Satralizumab的上市许可申请。
4.百济神州PD-1第4个适应症上市申请获受理。百济神州PD-1替雷利珠单抗注射液第四项上市申请获CDE受理,适应症为联合化疗用于治疗非鳞状非小细胞肺癌。此前,该药已在中国获批用于霍奇金淋巴瘤和尿路上皮癌,其一线治疗晚期鳞状非小细胞肺癌的第三项适应症也已在今年4月提交。根据百济神州第一季度财报,替雷利珠单抗注射液自2020年3月在中国商业发布以来的产品收入为2053万美元。
5.璧辰医药BRAF抑制剂美国Ⅰ期临床进展。璧辰医药口服小分子BRAF抑制剂ABM-1310在美国开展的Ⅰ期临床完成首例患者入组和给药。该研究是一项多中心、开放式、剂量递增的临床研究,旨在探索ABM-1310在BRAF突变晚期恶性肿瘤患者和脑转移患者中的药物安全性、耐受性、药代动力学, 以及初步抗肿瘤活性,为Ⅰb/Ⅱ期临床研究确定最佳剂量。ABM-1310是该公司的首个候选药物,在动物模型中已显示出血脑屏障渗透方面的独特优势。
6.复创医药两款抗肿瘤1类新药获批临床。复星医药旗下复创医药两款1类新药FCN-159片、FCN-011胶囊各获得两项临床试验默示许可。FCN-159是一款MEK抑制剂,该药此前已获批“单剂或与其他抗肿瘤药联用治疗具有BRAF或RAS突变的晚期实体肿瘤”的两项临床研究,本次获批的临床适应症为“需全身治疗的1型神经纤维瘤”。FCN-011为小分子化学药物,本次是该在研药首次在中国获批临床研究,拟开发用于NTRK基因融合阳性的实体瘤患者。
国际药讯
1.Keytruda治疗皮肤鳞状细胞癌获FDA批准。FDA批准默沙东PD-1抑制剂Keytruda扩展适应症,用于治疗不能通过手术或放疗治愈的复发/转移性皮肤鳞状细胞癌(cSCC)患者。在一项临床试验KEYNOTE-629中,Keytruda在未曾接受过免疫检查点抑制剂治疗的cSCC患者中客观缓解率达34%(95%CI:24,44),中位缓解持续时间尚未达到(2.7,13.1+个月)。Keytruda自2014年首度获批治疗晚期黑色素瘤以来,已获批治疗肺癌、头颈癌、胃癌、肝细胞癌等20多项适应症。
2.Zogenix芬氟拉明获FDA批准治疗罕见儿童癫痫。FDA批准Zogenix公司Fintepla(芬氟拉明)口服溶液上市,治疗2岁及以上患者与Dravet综合征相关的癫痫发作。在一项扩展试验中,与安慰剂相比,Fintepla显著降低患者每月癫痫发作频率。该扩展试验中,超过37%的患者在中位治疗时间达到445天时,癫痫发作频率降低了75%以上。而且长期安全性研究没有发现患者出现原发性肺动脉高压和心脏瓣膜病。芬氟拉明曾于1973年在美国获批上市,是一款抑制食欲的减肥药,后因发现该药物与少数患者中出现的原发性肺动脉高压以及心脏瓣膜病相关,于1997年从美国市场撤市。
3.瑞德西韦获欧盟CHMP推荐批准。6月25日,欧盟CHMP推荐有条件批准吉利德科学Veklury(remdesivir,瑞德西韦)上市,用于12岁以上COVID-19重症患者。这是欧盟推荐批准的首个COVID-19治疗药物。remdesivir目前已获得FDA的紧急授权,并在日本获得了正式批准。瑞德西韦联合其他疗法的临床试验正在进行中,其吸入式制剂的临床试验也已获得FDA批准启动。吸入式制剂将通过雾化器给药,这将使患者在疾病的早期阶段、在医院外更简便的用药成为可能。
4.Axsome创新疗法获FDA突破性疗法认定。Axsome Therapeutics新型口服NMDA受体拮抗剂AXS-05获FDA授予突破性疗法认定,适应症为阿尔茨海默病患者的躁动症状。这是该药获得的第二个突破性疗法认定。在一项临床试验ADVANCE-1中,AXS-05治疗组第5周的CMAI评分(评估躁动症状)平均总分降低15.4分,而安慰剂组平均降低11.5分(p=0.010)。AXS-05在CMAI总分上也优于安非他酮单药疗法(p<0.001)。同时AXS-05耐受性良好,与认知障碍或镇静无关。
5.口服GnRH受体拮抗剂III期临床达全部终点。Myovant公司评估GnRH受体拮抗剂relugolix组合疗法(relugolix 40mg + 雌二醇1.0mg + 醋酸炔诺酮0.5mg)治疗女性子宫内膜异位症相关疼痛SPIRIT项目的第2项III期SPIRIT 1研究结果积极。与安慰剂相比,relugolix组合疗法达到了共同主要疗效终点和全部7个关键次要终点。relugolix组合疗法组有74.5%、安慰剂组有26.9%痛经有临床意义的减轻(p<0.0001);relugolix组合疗法组有58.5%、安慰剂组有39.6%非月经性盆腔疼痛有临床意义的减轻(p<0.0001)。该组合疗法使患者相关疼痛降幅达73.3%。研究中,relugolix组合疗法的耐受性良好,治疗24周显示出最小的骨密度丢失。
6.吉利德加码肿瘤免疫布局。吉利德拟以2.75亿美元收购致力于开发“first-in-class”癌症免疫疗法的Pionyr Immunotherapeutics公司49.9%的股权,同时获得后者在研产品的独家选择权。目前Pionyr的2款髓样调节疗法PY314(靶向TREM2)和PY159(靶向TREM1)在临床前研究中已显示出疗效。其muPY314组合能够降低小鼠CT26结肠癌肿瘤的免疫抑制性肿瘤相关巨噬细胞群体和升高抗肿瘤T细胞。Pionyr计划在今年第三季度向FDA提交新药申请。如果吉利德行使选择权,Pionyr可能会另外获得高达14.7亿美元的期权执行费和未来的里程碑付款。
医药热点
1.广西17项民族医技法纳入医保。日前,广西壮族自治区医保局制定《关于部分民族医技法纳入基本医疗保险医疗服务项目的通知》。《通知》明确将壮医经筋针刺、壮医点穴疗法、壮医敷贴治疗、壮医刮痧治疗、小儿经筋推拿和瑶药坐盆治疗等17项壮、瑶医技法项目纳入医保支付范围,按甲类项目管理,城镇职工医保按在职、退休人员类别报销比例为85%~90%,城乡居民医保按不同就医医疗机构等级报销比例为50%~85%。
2.北京本次疫情病毒为欧洲家系。6月26日,中国疾病预防控制中心官网发布的《2020年6月北京新型冠状病毒肺炎疫情进展》称,北京本次疫情流行的新冠病毒为L基因型欧洲家系分支Ⅰ,排除动物病毒外溢和武汉流行毒株导致的可能性。大规模人群检测结果提示,与新发地批发市场无关的人群感染率极低,北京疫情近期有望得到控制。目前,国家卫健委已协调全国12个省20支核酸检测队支援北京,同时协调天津、河北分担北京部分检测任务。
3.西班牙去年3月废水样本中检出新冠病毒。西班牙巴塞罗那大学26日发布公告称,该校的一个肠道病毒研究小组在去年3月12日采集的巴塞罗那废水样本中检测出新冠病毒。公告称,该研究小组对当地2018和2019年的废水样本做了聚合酶链式反应(PCR)检测,发现于2019年3月12日采集的废水样本中该检测呈阳性,且新冠病毒水平非常低,其他样本的检测结果均为阴性。这一研究结果表明世界其他地区很可能也发生了类似情况,许多病例或因被误诊为流感病例而被掩盖。
股市资讯
【复星医药】(1)子公司复星医药产业及重庆复创获FCN-159片临床试验通知书,该新药为MEK1/2选择性抑制剂,拟主要用于晚期实体瘤、I型神经纤维瘤的治疗。2019年度,MEK1/2选择性抑制剂于全球的销售额约为9.16亿美元。(2)子公司复星医药产业产品RT002用于中重度眉间纹治疗获国家药监局临床试验注册审评受理。
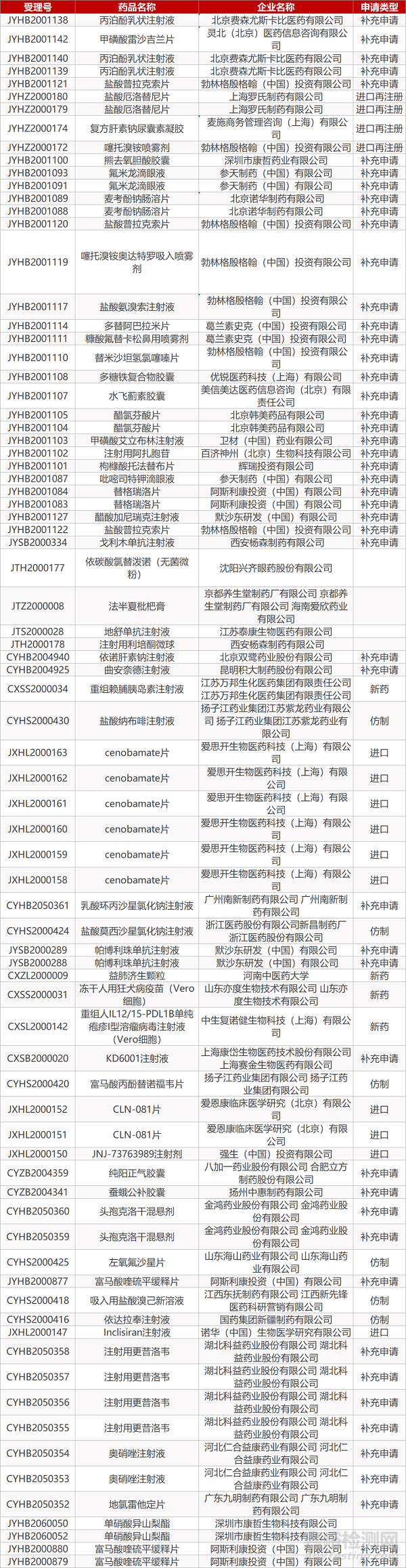
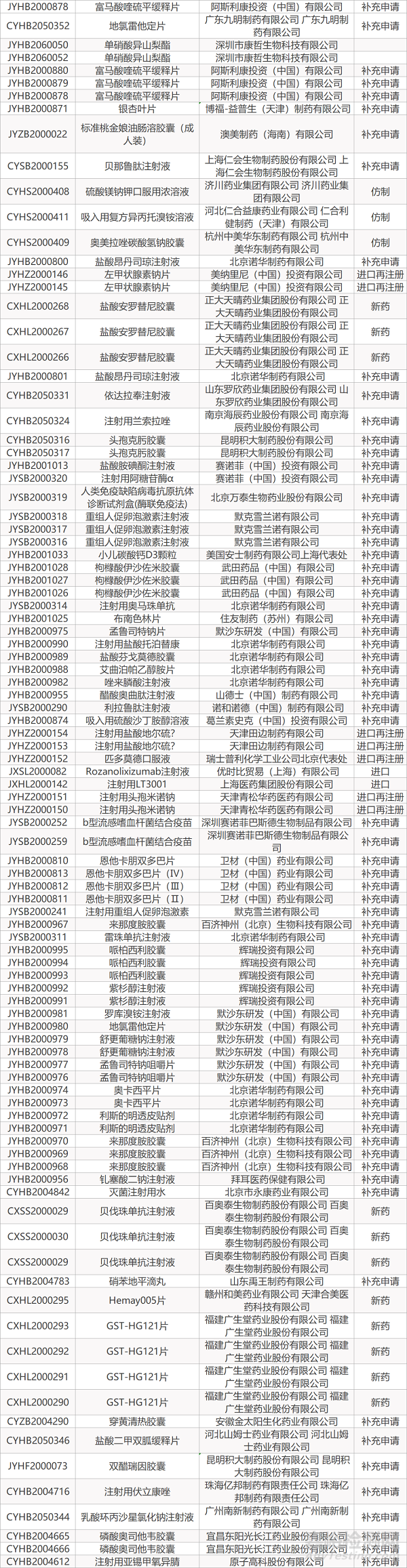
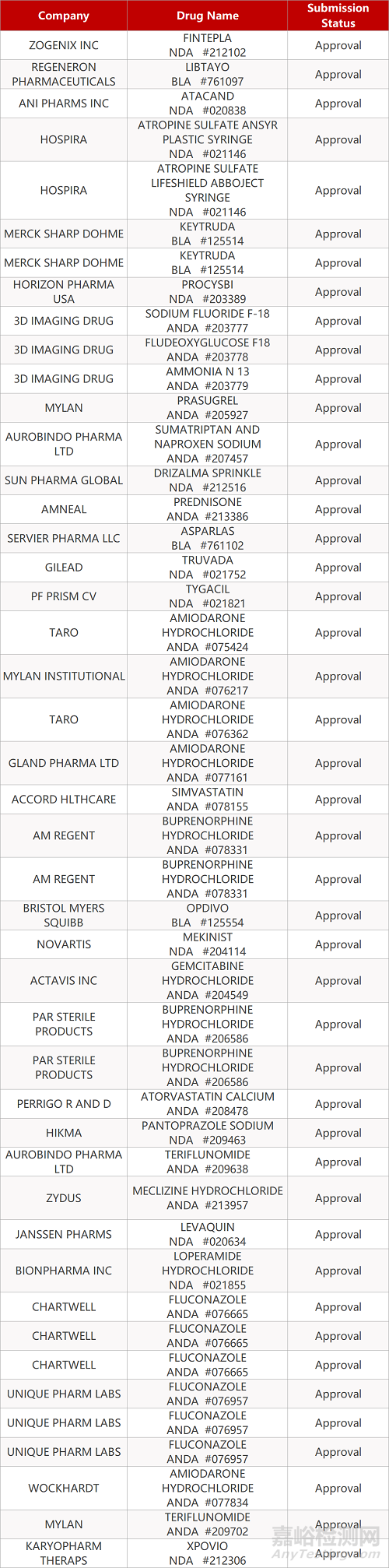
审评动向
- The End -

来源:药研发


