您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-19 09:38
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
罗氏IL-6抗体在华申请上市。罗氏旗下拟用于视神经脊髓炎谱系疾病(NMOSD)的IL-6R抗体satralizumab的上市申请获国家药监局受理。在一项Ⅲ期临床中,satralizumab单药治疗将NMOSD患者复发风险降低55%,96周和48周的无复发比例分别为76.1%和72.1%,安慰剂组这一数值为61.9%和51.2%。在另一项Ⅲ期临床中,与安慰剂组相比,satralizumab联合标准疗法可将患者复发风险降低62%,96周和48周的无复发比例分别为77.6%和88.9%,而安慰剂组这一比例为58.7%和66%。目前该药已在美国和欧洲提交了上市申请,今年有望获批。
国内药讯
1.中国首个氘代药物获批上市。梯瓦旗下创新药物安泰坦®(氘代丁苯那嗪片)获国家药监局批准用于治疗与亨廷顿病(HD)有关的舞蹈病及成人迟发性运动障碍(TD)。氘代丁苯那嗪片是一种囊泡单胺转运体 2(VMAT2)抑制剂,于2017年获FDA批准上市,商品名为 AUSTEDO™,是全球首个获批的氘代药物。2018年11月该品种被列入国家第一批临床急需境外新药名单中。中国是美国之后全球第二个批准该药物的国家。
2.阿斯利康格隆溴铵福莫特罗吸入气雾剂获批。阿斯利康开发的格隆溴铵福莫特罗吸入气雾剂(Bevespi)获国家药监局批准上市,用于治疗慢性阻塞性肺病(COPD)。该药由长效毒蕈碱拮抗剂(LAMA)格隆溴铵和长效β2激动剂(LABA)富马酸福莫特罗组成,是首个通过压力定量吸入气雾剂(pMDI)给药的长效双组分支气管扩张剂。与三联疗法(Breztri,2019年12月在中国获批)相比,Bevespi少了布地奈德成分。
3.天境生物CD73单抗TJD5Ⅰ/Ⅱ期临床首例患者给药。天境生物CD73抗体TJD5(TJ004309)中国Ⅰ/Ⅱ期临床首例患者给药(CTR20200445;NCT04322006)。该研究为多中心、开放标签、剂量递增和队列扩展研究,拟在晚期或转移的难治性肿瘤患者中评估TJD5的安全性、耐受性、药代动力学、药效动力学和疗效,并为进一步研究TJD5单药,及与拓益®(特瑞普利单抗)联合用药的药效和安全性提供参考剂量。
4.康希诺生物新冠疫苗在加拿大获批临床。康希诺生物于5月15日获得加拿大卫生部关于重组新冠病毒疫苗(腺病毒载体)——Ad5-nCoV临床试验申请的批准。据悉,该研究将与达尔豪西大学加拿大疫苗学中心合作开展。Ad5-nCoV采用基因工程方法构建,由康希诺生物与军事科学院军事医学研究院生物工程研究所联合研发。Ad5-nCoV是全球研究进展较快的新冠病毒候选疫苗之一。目前,Ad5-nCoV在中国已完成Ⅰ期临床受试者的接种工作,并进入Ⅱ期临床阶段。
5.科济生物靶向CAR-T疗法在美获批临床。科济生物自主研发的CAR-T细胞注射液(CT041)的新药临床试验申请获FDA批准。CT041是一款人源化抗Claudin18.2 (CLDN18.2)自体CAR-T疗法,用于治疗CLDN18.2表达阳性、既往经系统治疗后出现进展或复发的晚期胃腺癌/食管胃结合部腺癌、胰腺癌。临床前研究显示,CLDN18.2靶向的CAR-T细胞可以在小鼠体内高效清除胃腺癌,并具有很好的安全性,有望成为胃腺癌等肿瘤的新治疗手段。
国际药讯
1.COVID-19药物等无临床数据也可申报日本上市。日本厚生劳动省(MHLW)发布通知称,如果在公共资助的研究项目中确认对COVID-19治疗有效且安全的,可以在没有临床试验结果的情况下,接受药物的上市申请。在日本,对COVID-19潜在治疗药物的研究——包括富士胶片的流感药物法匹拉韦、帝人制药的吸入性皮质类固醇环索奈德和日医工制药的蛋白酶抑制剂萘莫司他,目前正在由MHLW和日本医疗研究开发机构(AMED)资助。在某些情况下,可以在没有临床试验数据的情况下,接受这些药物的上市申请。这项通知也适用于COVID-19相关的医疗器械、体外诊断和再生医学产品。
2.FDA批准Opdivo+Yervoy一线治疗非小细胞肺癌。FDA批准百时美施贵宝PD-1欧狄沃(纳武利尤单抗,Opdivo)联合CTLA-4抑制剂伊匹木单抗(Yervoy)扩展适应症,一线治疗PD-L1阳性(≥1%)、EGFR或ALK阴性的成人转移性非小细胞肺癌。在一项Ⅲ期临床CheckMate-227中的1a部分,Opdivo+Yervoy相比含铂双药化疗显著改善了中位总生存期(17.1 vs 14.9个月),将死亡风险降低21%。两组3年生存率(随访43.1个月时)分别是33%和22%,无进展生存率分别为18%和4%。该组合疗法此前已获FDA批准一线治疗具有中高度风险的晚期肾细胞癌患者,以及经治MSI-H/dMMR转移性结直肠癌患者。
3.辉瑞20vPnC针对18-49岁成人的Ⅲ期临床达终点。辉瑞公布一项20价肺炎球菌多糖结合疫苗(20vPnC)Ⅲ期临床(NCT03828617)的顶线结果。该研究评估三个不同批次20vPnC在尚未接种过抗肺炎球菌疫苗的18至49岁成人中引起免疫应答的一致性及安全性。结果显示,在三个批次中,20vPnC对所有20种血清型引发的应答是等效的;而且20vPnC的安全性与对照组Prevnar13®相似。据悉这是20vPnC的第二个Ⅲ期临床试验。
4.MarcroGenics公布多项创新抗体疗法最新结果。MarcroGenics公司在ASCO年会上,公布两项研究结果。其PD-1/LAG-3双特异性抗体MGF013,与靶向HER2、且Fc接受过改造的单抗margetuximab联用,在治疗14例晚期HER2阳性癌症患者时达到43%的总缓解率。(再鼎医药拥有这两款创新免疫疗法在大中华区的开发和推广权益);靶向B7-H3的抗体偶联药物MGC018在治疗转移性去势抵抗性前列腺癌患者(mCRPC)的Ⅰ/Ⅱ期临床中,有5例患者(n=7)的前列腺特异性抗原(PSA)水平下降超过50%,其中1例患者的骨转移瘤显著缩小。
5.Ayvakit四线治疗GIST被FDA拒绝批准。FDA拒绝批准Blueprint制药公司靶向抗癌药物Ayvakit(avapritinib)四线治疗胃肠道间质瘤(GIST)的新药申请。Ayvakit是一款多激酶抑制剂,已获FDA批准用于治疗携带PDGFRA基因18号外显子突变(包括PDGFRA D842V突变)的不可切除性或转移性GIST成人患者。基石药业拥有Ayvakit在大中华区的开发和商业化权益。在一项评估avapritinib与瑞戈非尼相比用于三线或四线治疗GIST的III期试验VOYAGER中,avapritinib治疗组中位PFS为4.2个月、瑞戈非尼组为5.6个月,研究未达主要终点。目前Blueprint已停止进一步开发avapritinib用于其他GIST适应症。
6.AZ/第一三共Enhertu获FDA第3个BTD认定。阿斯利康和第一三共联合开发的靶向HER2的抗体偶联药物(ADC)Enhertu获FDA授予的第3个突破性疗法(BTD)认定,用于治疗HER2阳性、在铂类治疗中或治疗后疾病进展的转移性非小细胞肺癌(NSCLC)患者。在一项经治HER2突变或过度表达的癌症患者参与的Ⅰ期临床中,Enhertu使28.3%的患者肿瘤缩小,并使患者的中位无进展生存期(PFS)达到7.2个月。其中,NSCLC患者的客观缓解率最高,有55.6%的患者肿瘤被缩小,中位缓解时间达10.7个月。在携带HER2突变的NSCLC患者中的疗效更为明显,Enhertu使该组中72.7%的患者得到缓解。
医药热点
1.中国团队发现可阻断新冠感染抗体。来自中国首都医科大学、中国科学院微生物研究所等多家单位的科研团队,从一名新冠康复患者的外周血单核细胞中分离出4种人源单克隆抗体,实验显示,这4种抗体对新型冠状病毒均有中和能力,其中,分别被称为B38和H4的两种抗体能够阻断新冠病毒刺突蛋白的受体结合域与其受体“血管紧张素转化酶2(ACE2)”的结合,这两种抗体有望用于抗新冠药物和疫苗的研发。相关研究成果已在线发表于美国《科学》杂志上。
2.北京新冠肺炎危重症病例清零。在北京市政府疫情防控新闻发布会上,北京市卫健委主任雷海潮介绍,截至5月17日,北京市确诊的593例病例中,在院病例降至7例,其中危重症病例降为零。疫情暴发后,北京市迅速确定了北京地坛医院、北京佑安医院和解放军总医院第五医学中心等20家市区两级定点医疗机构,并迅速启动小汤山战备医院,构建了比较完备的医疗救治体系,保证了相关病例的及时收治。雷海潮表示,接下来,北京市将进一步完善新冠肺炎疫情医疗救治体系。
股市资讯
【佐力药业】参股公司科济开曼的旗下公司研发的人源化抗Claudin18.2 (CLDN18.2)自体CAR T细胞注射液(CT041)临床试验(IND)申请收到了FDA获准开展临床试验的通知。
【以岭药业】公司计划在中国银行间市场交易商协会注册发行不超过人民币20亿元)的超短期融资券。
【广生堂】公司新型肝癌c-Met靶向药物GST-HG161已完成60~450mg共4个剂量组9例受试者的耐受性和安全性观察,正在开展600mg剂量组的招募和入组工作。
审评动向
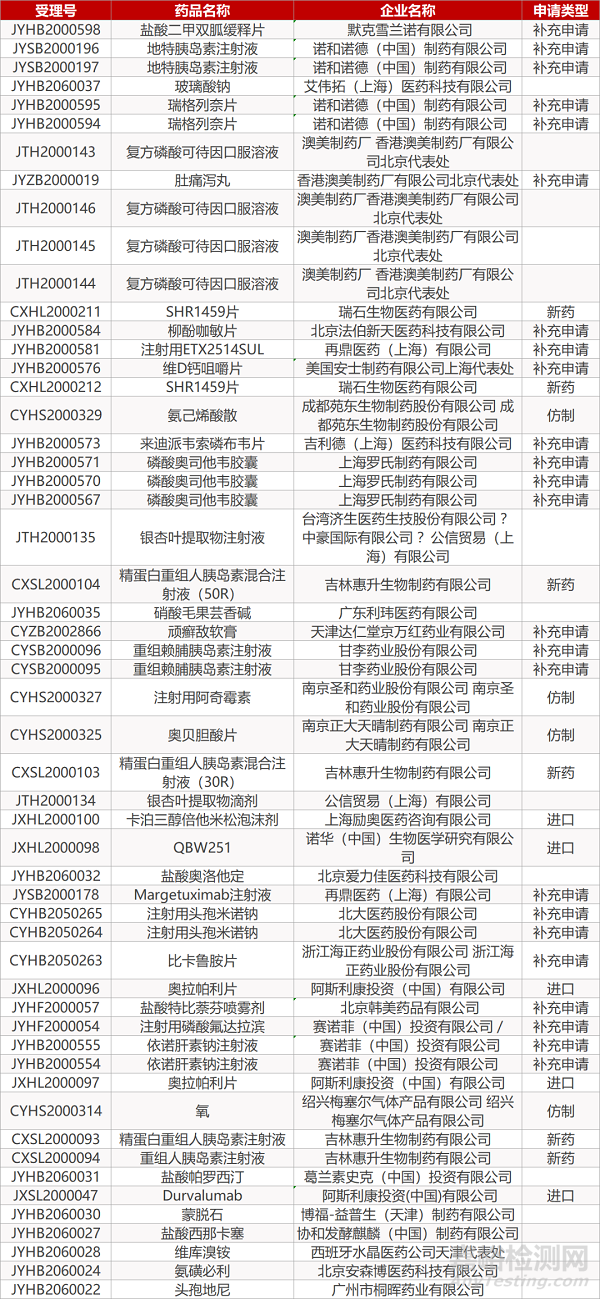
1. CDE最新受理情况(05月18日)
- The End -

来源:药研发


