您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-27 09:00
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
首项逆转衰老临床试验获伦理委员会批准。美国Libella基因治疗公司宣布获得哥伦比亚伦理委员会的批准,即将在当地开展逆转衰老的收费(临床试验费用100万美元)临床试验。该公司拟通过基因手段,使用AAV病毒导入人端粒酶逆转录酶基因,延长端粒长度,从而希望让人类逆转衰老20年。目前,该临床招募已被收录在美国临床试验数据库(ClinicalTrials.gov),计划招募5位45周岁以上的参与者。据悉,西班牙科学家通过基因治疗手段创造了拥有超长端粒的小鼠,它们的寿命比正常小鼠平均延长了13%,而且具有患癌症更少,对胰岛素和葡萄糖的耐受性更强等特点。
国内药讯
1.现代制药吲达帕胺片通过一致性评价。现代制药旗下吲达帕胺片(2.5mg)通过一致性评价并获《药品补充申请批件》。吲达帕胺片为磺胺类利尿剂,具有利尿和钙拮抗作用,是一种强效、长效的降压药,临床上主要用于治疗原发性高血压。该药原研药由施维雅研发,目前市场上已有片剂、缓释片、胶囊剂、滴丸等多种剂型在售。根据PDB药物综合数据库数据显示,吲达帕胺片2018年在全球销售额为8.19亿美元。
2.罗氏帕妥珠单抗第3个适应症即将获批。罗氏(Roche)旗下乳腺癌创新靶向药帕捷特®(Perjeta®,帕妥珠单抗)新适应症的上市申请办理状态变更为在审批,这将是继去年首次获批上市后,帕捷特在中国获批的第3个适应症。一项大型Ⅲ期临床试验CLEOPATRA研究显示,帕妥珠单抗+曲妥珠单抗用于一线治疗HER2阳性晚期乳腺癌,可以使患者总生存期(OS)提高到 56.5 个月,充分证实了双靶治疗是HER2阳性乳腺癌全程管理的标准方案。帕捷特是继赫赛汀之后,罗氏在中国上市的第二个乳腺癌靶向药物。2018年,赫赛汀销售额为71亿美元,帕捷特为23.59亿美元。
3.正大天晴苯达莫司汀即将获批上市。正大天晴申报的3类仿制药盐酸苯达莫司汀(Bendamuxtine Hydrochloride)的上市申请处于"在审批"状态,预计将于近日获批上市,用于非霍奇金淋巴瘤(NHL)的治疗。正大天晴有望拿下该品种首仿。盐酸苯达莫司汀是一种双功能基烷化剂,是通过烷化作用使DNA单链和双链交联,干扰DNA的功能和DNA的合成,从而发挥抗肿瘤作用。该药原研药最早于1993年在德国获批上市,商品名为Ribomustin,目前获批的适应症包括慢性淋巴细胞白血病(CLL)、惰性B细胞非霍奇金淋巴瘤(NHL)等。2018年12月,该原研药获批进口中国,商品名:存达。
4.GSK在中国提交艾滋病鸡尾酒疗法Dovato上市申请。葛兰素史克(GSK)艾滋病鸡尾酒疗法Dovato(多替拉韦/拉米夫定片)的上市申请获国家药监局受理。Dovato已在2019年4月、7月先后在美国和欧盟获批上市。Dovato在美国获批的适应症为无逆转录病毒治疗史且对Dovato中任一组分均无已知耐药性的HIV-1成人感染者。两项在成人HIV感染患者评估多替拉韦/拉米夫定片双联疗法和多替拉韦/替诺福韦/恩曲他滨三联疗法的疗效,结果表明,与三联疗法相比,双联疗法具有类似的降低血液中艾滋病毒含量的效果。
5.优科制药地佐辛注射液获批上市。南京优科制药地佐辛注射液获国家药监局批准上市,成为该品种国内第二家获批的产品。据了解,地佐辛是一款μ受体部分激动剂,该药原研药由Wyeth-Ayerst实验室研发,最早于1989年在美国获批上市,因原研公司的战略布局问题,于2000年退市,后经国内扬子江和合作伙伴天津药物研究院重新开发,于2009年获批上市,商品名加罗宁。目前,地佐辛被广泛应用于全麻诱导、术后镇痛和超前镇痛,扬子江该品种在2019年销售业绩高达60亿元。
6.燧坤智能完成数千万融资。燧坤智能公司宣布获得数千万元融资,由和玉资本领投,跟投方包括图灵创投、景旭创投和盛鼎资本。燧坤智能成立于2018年9月,是一家利用人工智能算法发掘疾病作用靶点、发现已知药物新适应症、提升新药筛选效率、提高大分子产量的AI+生物科技公司。本轮融资该公司将用于进一步优化和提升人工智能及机器学习算法的技术平台在新药研发中的应用,扩大战略合作,加速推进在研项目,持续加强技术团队建设。
国际药讯
1.镰状细胞贫血症治疗药物Oxbryta获加速批准。FDA加速批准Global Blood公司的创新疗法Oxbryta(voxelotor)上市,治疗成人和12岁以上青少年患者的镰状细胞贫血症(SCD)。这也是首款FDA批准的靶向血红蛋白聚合过程的创新疗法,该疗法此前已获FDA授予突破性疗法认定、孤儿药资格、快速通道资格和罕见儿科疾病认定。一项临床结果显示,与安慰剂相比,剂量为1500 mg的voxelotor可将59.5%的患者血红蛋白水平提高超过1 g/dL,显著降低SCD患者临床并发症和死亡率。
2.利鲁唑口腔膜剂获FDA批准上市。Aquestive Therapeutics公司宣布,FDA已批准Exservan(riluzole,利鲁唑)口腔膜剂,用于肌萎缩侧索硬化症(ALS)患者的治疗。Exservan是利鲁唑的一种口腔膜剂,利鲁唑是FDA批准的首款治疗ALS的药物,用于推迟ALS患者对呼吸机的依赖、延长生命。利鲁唑自1995年12月以来作为片剂上市销售,品牌名为Rilutek。截止目前,已有4款药物获FDA批准治疗ALS,除了Exservan(利鲁唑口腔膜剂)和Rilutek(利鲁唑片剂)之外,还包括Tiglutik(利鲁唑混悬剂)、Radicava(edaravone,依达拉奉静脉注射液)。
3.渤健Tecfidera升级产品Vumerity胃肠道耐受性大幅改善。渤健(Biogen)公司公布Vumerity(diroximel fumarate,BIIB098) III期EVOLVE-MS-2研究的详细数据。Vumerity是一款于10月底获FDA批准治疗复发型多发性硬化症(RMS)的口服新药,是渤健已上市药物Tecfidera(dimethyl fumarate,DMF,富马酸二甲酯)的升级版。EVOLVE-MS-2研究旨在评估Vumerity相对于Tecfidera的耐受性,主要终点的结果显示,与Tecfidera相比,Vumerity治疗的患者自我报告的IGISIS(胃肠道恶心、呕吐、上下腹痛等症状的强度和持续时间)强度评分≥2的天数减少了46%(调整后的比值比[95%CI]:0.54[0.39-0.75],p=0.0003)。在该研究中,Tecfidera观察到的结果与该药已知的安全性一致。
4.罗氏口服SMA疗法获优先审评。罗氏宣布,FDA已接受risdiplam的新药上市申请,并授予其优先审评资格,预计将在2020年5月24日前做出批准决定。Risdiplam是一种用于治疗脊髓性肌萎缩症(SMA)的SMN2基因的mRNA剪接修饰剂,由罗氏旗下基因泰克、PTC Therapeutics公司和SMA基金会联合开发。该药此前已获FDA授予孤儿药资格和快速通道资格认定,Risdiplam的NDA申请基于FIREFISH和SUNFISH关键性研究结果,Risdiplam在这两项试验中均展现出积极的临床疗效。迄今为止,在任何risdiplam试验中均未观察到导致研究退出的治疗相关安全性事件。
5.Ferring 公司和黑石生命科学达成战略合作。Ferring Pharmaceuticals公司与黑石生命科学(Blackstone Life Sciences)将共同投资开发一种基于腺病毒载体的新型基因疗法nadofaragene firadenovec(rAd-IFN/Syn3),用于治疗对卡介苗(BCG)反应不佳的晚期高级非肌层浸润性膀胱癌(high grade NMIBC)患者。这款由FerGene公司(Ferring子公司)开发的基因疗法正处于Ⅲ期阶段,Ⅲ期试验结果将于第20届泌尿外科肿瘤协会年会上公布,此前FDA已授予它突破性疗法认定和优先审评资格。根据协议,Ferring将向FerGene公司投资1.7亿美元,黑石生命科学将向FerGene公司投资4亿美元,加速该款基因疗法的开发和商业化发展。
医药热点
1.颜宁团队又破解一个离子通道结构。颜宁教授团队在《自然》发表一篇解构电压门控钙离子通道(Cav)的科研论文。该研究聚焦低电压激活的Cav3.1通道。研究人员利用冷冻电镜技术,测定重组表达的人类Cav3.1蛋白的结构,分辨率达到3.3埃;还使用高选择性的Cav3阻滞剂Z944,捕获Cav3.1与Z944相结合时的复合体冷冻电镜结构,分辨率达3.1埃。多年来,颜宁教授的研究组在解构Cav通道的征程上多次取得关键突破。解析Cav结构的一系列研究可以比较不同亚家族之间的特性,对“为治疗各类Cav通道疾病提供了结构指导药物发现的框架”有重要指导意义。
2.结直肠腺瘤癌变基因图谱绘出。北京大学第三医院付卫研究团队与北京大学汤富酬研究团队联合在学术期刊《肠道》上在线发表论文,深入探究了结直肠癌的发生发展过程,揭示了腺瘤发生和癌变过程中的重要基因突变和转录组变化特征,为结直肠癌预防、早期筛查和治疗提供了新的线索和思路。据悉,结直肠癌是全球范围内发病率第三、致死人数第四的恶性肿瘤,结直肠腺瘤是结直肠癌的癌前病变,从低级别腺瘤发展为腺癌需要10年以上时间。
3.陕西确定儿童血液病定点医院。陕西省卫健委等多部门联合发布《关于做好儿童血液病和恶性肿瘤医疗救治及保障管理工作的通知》,明确该省首批列入救治管理的10个病种,并确定首批儿童血液病定点医院及儿童恶性肿瘤诊疗协作组医院。儿童血液病定点医院为西安市儿童医院、西北妇女儿童医院、西安交通大学第二附属医院;儿童恶性肿瘤诊疗协作组医院为西安交通大学第二附属医院、西安交通大学第一附属医院、西北妇女儿童医院、空军军医大学唐都医院、西安市儿童医院、陕西省人民医院。
【太极集团】(1)控股子公司西南药业异烟肼片通过仿制药一致性评价。(2)公司产品藿香正气口服液、急支糖浆获得巴基斯坦准入批文。
【景峰医药】重组人截短型纤溶酶注射液项目获得临床试验默示许可。
【华润双鹤】下属公司浙江新赛科通过“原料药(左乙拉西坦)”GMP认证。
审评动向
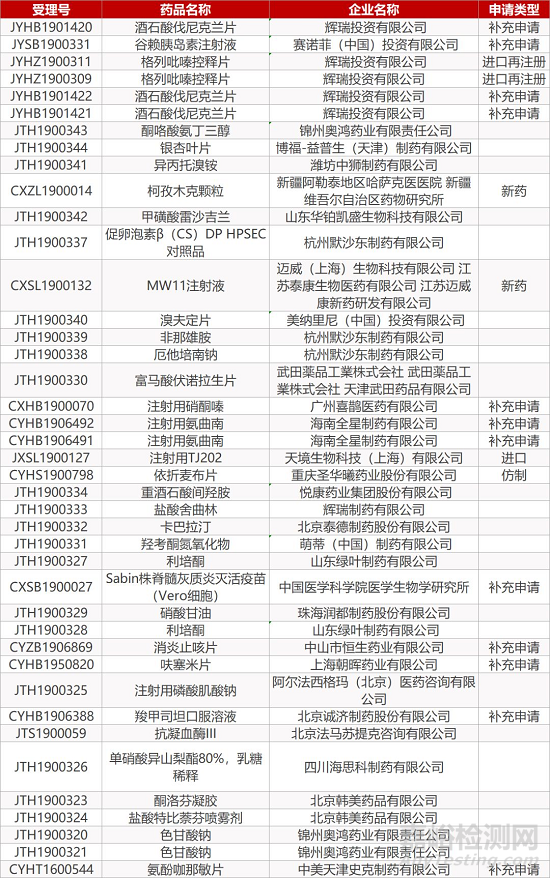
1. CDE最新受理情况(11月26日)
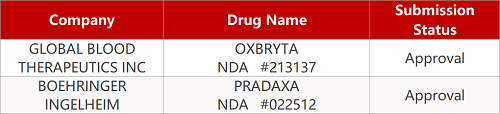
2. FDA最新获批情况(北美11月25日)

来源:药研发


