您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-18 09:14
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
百济神州原研抗癌药获FDA批准上市。FDA宣布加速批准百济神州的新药泽布替尼(zanubrutinib)上市,治疗经治的套细胞淋巴瘤。此次批准比预定回复日期提早了近4个月。泽布替尼是百济神州自主研发的一款具“best-in-class”潜力的口服BTK小分子抑制剂,它也是首个获FDA四大特殊通道资格认定的中国自主研发抗癌新药。在一项涉及86例经治套细胞淋巴瘤患者的单臂临床试验中,泽布替尼使84%的患者肿瘤缩小,中位缓解持续时间为19.5个月。
国内药讯
1.健友股份那屈肝素钙注射液新增规格获批。健友股份那屈肝素钙注射液增加2个规格(0.6ml:6150IU、0.3ml:3075IU)获国家药监局批准,并获视同通过一致性评价。那屈肝素钙注射液是一种新型的抗血栓形成药,适用于在外科手术中,用于静脉血栓形成中度或高度危险的情况,预防静脉血栓栓塞性疾病;治疗已形成的深静脉血栓;联合阿司匹林用于不稳定性心绞痛和非Q波性心肌梗塞急性期治疗;在血液透析中预防体外循环中的血凝块形成。2018年,该品种的中国公立医疗机构终端销售额约为10亿元人民币。
2.天麦生物胰岛素胶囊IIb期临床结果积极。天麦生物与以色列奥拉姆德公司共同研发的口服胰岛素创新药ORMD-0801 IIb期临床结果积极。口服降糖药治疗效果不佳的2型糖尿病患者参与该研究,治疗90天后,随机每天接受一次ORMD-0801治疗的患者达到主要终点,患者Hb A1c比基线水平平均下降达到0.6%,或对安慰剂进行校正后,Hb A1c平均下降0.54%(p值=0.036)。另外,ORMD-0801还显示出良好的安全性,没有出现与药物相关的严重不良事件,也没有增加低血糖事件的发作频率。ORMD-0801目前也正在中国开展临床试验。
3.振兴生化人纤维蛋白粘合剂获批临床。振兴生化旗下人纤维蛋白粘合剂(Human Fibrin Sealant Kit)获国家药监局临床批件。人纤维蛋白粘合剂适应症:局部止血药。辅助用于处理烧伤创面、普通外科腹部切口、肝脏手术创面和血管外科手术创面的渗血。据悉,和猪血源纤维蛋白粘合剂相比,人纤维蛋白粘合剂具有更高的安全性和更好的生物相容性。目前国内持有有效人纤维蛋白粘合剂生产批文的厂家仅有3个。
4.信达生物JAK1抑制剂Itacitinib获批临床。Incyte与信达生物联合提交的JAK1抑制剂Itacitinib临床申请获国家药监局批准。适应症为移植物抗宿主病。该品种是2018年信达获Incyte公司授权的3款新药之一。此前另两款新药pemigatinib(FGFR1/2/3 抑制剂)和 parsaclisib(PI3Kδ抑制剂)已相继在国内获批临床,分别用于胆管癌和复发/难治滤泡性淋巴瘤和边缘区淋巴瘤。据Incyte公司披露,itacitinib目前正在开展两项针对移植物抗宿主病的Ⅲ期临床试验,并完成了该药与EGFR抑制剂奥希替尼组合二线治疗EGFR突变阳性非小细胞肺癌的Ⅰ/Ⅱ期临床研究。
5.艾伯维在华提交三项JAK1抑制剂临床申请。艾伯维在中国提交的第三项JAK1抑制剂Rinvoq(upadacitinib)的临床申请获国家药监局受理。这款新药8月刚获FDA批准用于治疗中重度活动性类风湿性关节炎(RA)成年患者。一项针对RA的Ⅲ期临床SELECT结果显示,有52%的患者在接受Rinvoq治疗12周后达到ACR50(RA症状改善超过50%),而甲氨蝶呤组这一数值仅为28%;Rinvoq治疗组超过30%的患者能够进入临床缓解期,临床缓解持续时间可高达26周。目前,艾伯维正在开展Rinvoq治疗RA、克罗恩病、溃疡性结肠炎、特应性皮炎、银屑病关节炎、轴痉挛和巨细胞动脉炎多种疾病的研究。
国际药讯
1.盐野义创新抗生素获FDA批准上市。盐野义公司的新型铁载体头孢菌素类抗生素Fetroja(cefiderocol)获FDA批准用于治疗18岁以上复杂性尿路感染(cUTI)患者,包括由易感性革兰氏阴性菌造成的肾脏感染。一项包含448例cUTI患者的临床研究结果显示,接受Fetroja治疗的患者中,72.6%在完成治疗7天后症状消失并且细菌得到清除,而使用其它抗生素的对照组中这一数值为54.6%。
2.诺华镰状细胞贫血症疗法获FDA批准上市。诺华靶向P选择素(P-selectin)的单克隆抗体药物Adakveo(crizanlizumab,SEG101)获FDA批准上市,用于16岁以上镰状细胞贫血症(SCD)患者降低血管阻塞危机(VOC)的发生频率。这是FDA批准治疗VOC的首款靶向疗法。一项临床结果显示,接受Adakveo治疗的患者每年因VOC接受治疗的次数为1.63次,比对照组(2.98次)降低45%(p=0.010)。而且接受Adakveo治疗的患者中36%在临床试验中未出现任何VOC,Adakeveo将接受治疗后第一次出现VOC的时间从1.4个月推迟到4.1个月。
3.FDA批准首款延缓儿童近视发展的隐形眼镜。CooperVision公司开发的一次性使用的隐形眼镜MiSight获FDA批准,用于8~12岁儿童延缓近视发展。一项为期3年的临床研究显示,佩戴MiSight隐形眼镜的8~12岁儿童近视进展小于佩戴传统隐形眼镜的儿童;而且他们的眼轴长度每年的变化更小。此外,FDA根据真实世界数据,研究分析发现儿童佩戴隐形眼镜出现角膜感染的几率与成人相当。FDA使用上市前批准途径(PMA)对MiSight的申请进行批准,CooperVision需要进行上市后研究,进一步评估这一隐形眼镜的安全性和有效性。
4.Amarin公司“鱼油”处方药即将获批。Amarin公司宣布FDA专家咨询委员会以16:0的投票结果支持批准Vascepa用于降低心血管风险的新适应症。Vascepa有望成为FDA批准的首款可用于降低高血脂患者LDL-C水平升高之外其他原因所导致的心血管风险的药物。Vascepa是一款从鱼油中分离提取出的高纯度ω-3多不饱和脂肪酸,其中二十碳五烯酸乙酯(EPA)的纯度达到97%。该药此前已获FDA批准作为饮食辅助疗法用于降低严重高甘油三酯血症(TG≥500 mg/dL)成人患者的甘油三酯水平,是FDA批准的首个EPA处方药。
5.神经纤维瘤病新药获优先审评资格。阿利斯康与默沙东联合开发的MEK1/2抑制剂selumetinib的新药申请获FDA受理,用于治疗3岁及以上携带有不能通过手术治疗的丛状神经纤维瘤(PNs)的1型神经纤维瘤病(NF1)患者。FDA同时授予其优先审评资格,预计将在明年第二季度作出回复。selumetinib有望成为治疗携带PN的NF1儿童患者的首款疗法。selumetinib此前也已获FDA授予的孤儿药资格和突破性疗法认定。一项Ⅱ期试验SPRINT结果显示,接受selumetinib单药治疗的患者达到66%的客观缓解率,其中包含达到完全缓解和肿瘤体积缩小幅度超过20%的患者。
6.武田扩大与Finch的研发合作。微生物组学公司Finch Therapeutics将扩大一项与武田的合作协议。两家公司将利用Finch的Human-First Discovery平台,开发靶向克罗恩病(CD)的微生物组学药物。Finch的Human-First Discovery平台包括全谱微生物(FSM)产品以及理性选择的微生物群(RSM)产品。前者来源于健康人粪便的全谱微生物,后者是采用创新的机器学习算法,基于高通量微生物分子数据,反向分析推导构建的,在纯培养基中培育出来的精选微生物组学疗法。Finch与武田此前联合开发的FIN-524是一款基于RSM的产品,用于治疗溃疡性结肠炎。
医药热点
1.原CFDA副局长吴浈一审宣判:有期徒刑16年。2019 年 11 月 15 日上午,四川省成都市中级人民法院一审公开宣判原国家食品药品监督管理总局党组成员、副局长兼国家卫生和计划生育委员会副主任吴浈受贿、滥用职权案,对被告人吴浈以受贿罪判处有期徒刑十一年,并处罚金人民币一百万元;以滥用职权罪判处有期徒刑九年,决定执行有期徒刑十六年,并处罚金人民币一百万元。对吴浈受贿所得财物及其孳息予以追缴,上缴国库。
2.中国糖尿病患者预估约1.16亿。国际糖尿病联合会(IDF)发布第9版《IDF全球糖尿病概览》。《概览》显示,目前全球预估有4.63亿名成年人患有糖尿病,比2017年增加3800万人;中国糖尿病患病率已达10.9%,预估有1.16亿名成年人患有糖尿病,其中超过6500万人尚未确诊。据了解,2型糖尿病患者人数的增加是社会经济、人口、环境和遗传因素共同作用的结果。主要诱因包括城市化、人口老龄化、身体活动减少以及超重和肥胖程度日益严重。此外,1型糖尿病患病率也在上升,原因尚不明确。
3.卫材仑伐替尼医保谈判失败。卫材乙肝新药乐卫玛(仑伐替尼)在近日的医保谈判中未能通过谈判进入国家医保目录。仑伐替尼是血管内皮生长因子受体(VEGFR)1~3、成纤维细胞生长因子受体(FGFR)、血小板衍生生长因子受体(PDGFR)α、RET及KIT抑制剂,是中国第二个上市的肝癌一线靶向治疗药物。目前乐卫玛在国内的最新中标价为16800元/4mg/30粒,体重小于60kg的患者全年治疗费用约408800元,在赠药政策下该药的年治疗费用也达到134400元。
4.重庆力推社区居家养老全覆盖。重庆市人民政府印发《重庆市社区居家养老服务全覆盖实施方案》明确,到2020年,全市所有街道、社区基本实现养老服务设施全覆盖。到2022年,全市所有乡镇、行政村基本实现养老服务设施全覆盖,城市养老服务设施社会化运营率达到90%以上,农村养老服务设施社会化运营率达到60%以上,城乡养老设施具备医养服务能力的比例达到100%。
【恒瑞医药】1)设计年产能3000万粒的2203生产车间获得药品GMP证书,代表产品为细胞周期特异性抗肿瘤药物依托泊苷软胶囊。2)子公司上海恒瑞收到国家药监局核准签发的关于吸入用七氟烷的《药品补充申请批件》,受理号为CYHB1806325。
审评动向
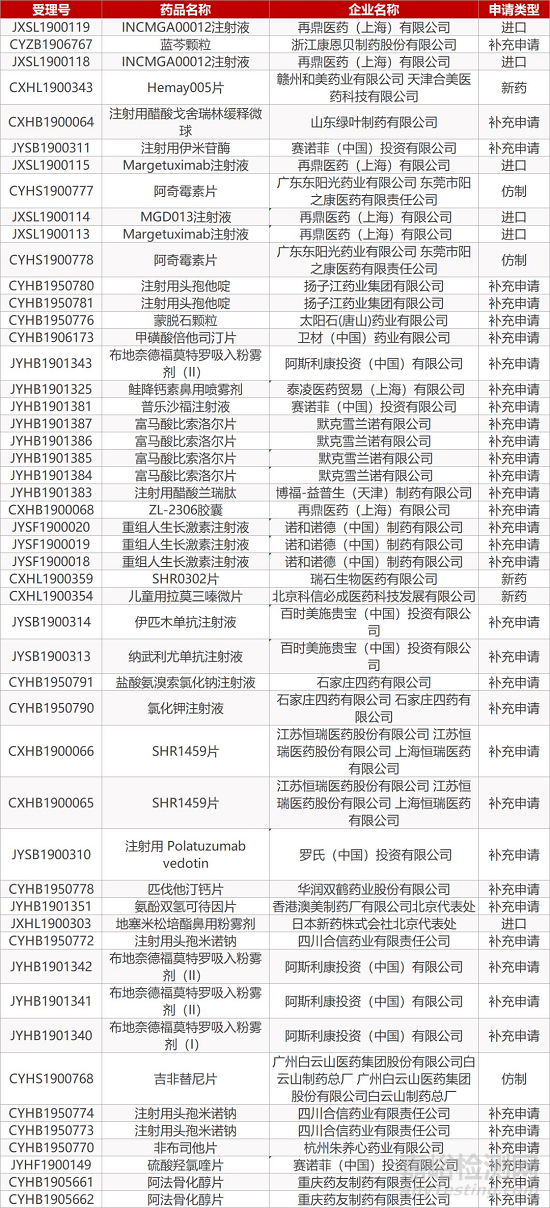
1. CDE最新受理情况(11月17日)
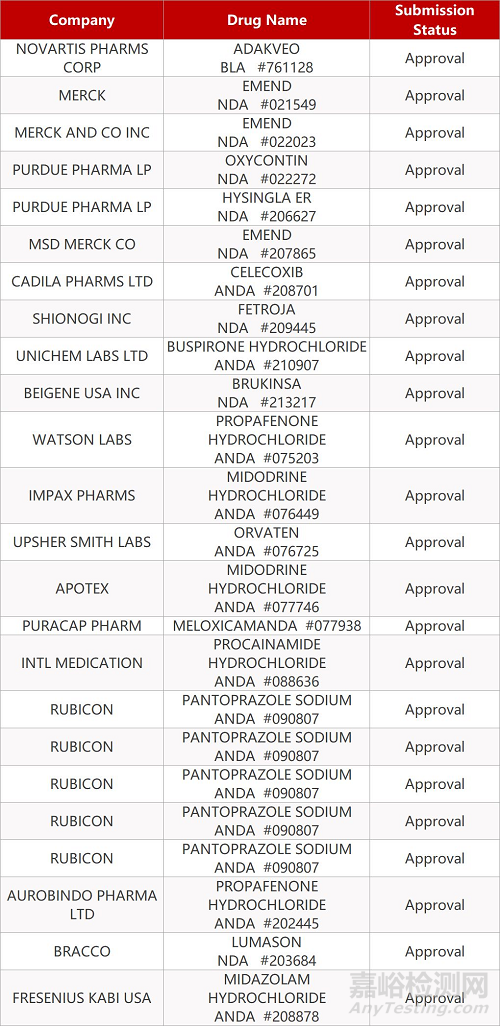
2. FDA最新获批情况(北美11月16日)

来源:药研发


