您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-04-03 09:21
今天,咱们再好好聊聊ISO 10993-10:2010 皮肤致敏测试。
皮肤致敏测试概述
目前,有三种动物试验可用于化学物质的皮肤致敏测试,包括两种豚鼠试验和一种小鼠试验。其中,最常用的是豚鼠最大限度法(GPMT)和豚鼠局部封闭敷贴法(Buehler test)。
GPMT是最敏感的测试方法,Buehler test是最适合于局部使用产品的测试方法,而小鼠局部淋巴结试验(LLNA)是除豚鼠试验外国际公认的用于测试单一化学物质的测试方法。接下来,本文将从测试原则、测试样本和动物准备、测试过程、测试观察以及结果和讨论这几部分,和大家梳理每种测试的要求。
小鼠局部淋巴结试验(LLNA)
1. 测试原则
在实验动物的耳朵背部给与测试样品,并在淋巴结中测量淋巴细胞的增殖程度(除耳朵部位)。若与对照组相比,试验组的细胞增殖反应为三倍及以上,则将该反应定为测试材料为敏化剂的阈值。对于医疗器械产品,可使用未稀释的提取液进行测试。
2. 测试样本和动物准备
测试样本可以是应用于小鼠耳朵的液体、混悬液、胶体或粘性物质。通常应使用系列浓度进行测试,否则使用最高浓度。常用的提取液是丙酮橄榄油(AOO)4:1的混合物。若是亲水性的且无法粘附于皮肤的液体样本,则可加入羧甲基纤维素或羟乙基纤维素(0.5%w/v)。若是水溶性的化学物质,则可添加二甲基亚砜(DMSO)或二甲基甲酰胺(DMF)。
但要注意的是,样本制备过程中使用的任何提取液或添加物,都应该进行验证和记录,证明其不会影响测试结果。
测试动物应优选健康的CBA/Ca或CBA/J雌性小鼠(非怀孕,8-12周龄),其他选择包括DBA/2、B6C3F1和BALB/c,小鼠应在一周龄波动范围内进行匹配。动物选择和饲养应按照ISO 10993-2标准要求。
3. 测试过程
对于化学物质,LLNA测试通常以剂量-反应方式进行。对于医疗器械,待测样品因为是提取物,所以常用单剂量测试,而且不进行稀释。但是,当提取物含有高毒性成分时,可能会导致LLNA阴性反应。因此,在研究高毒性提取物时,建议稀释提取物并以剂量-反应方式进行LLNA。
为确保测试再现性和灵敏度,可使用弱至中等接触性过敏原进行测试,如巯基苯并噻唑、己基肉桂醛和苯佐卡因。研究期间应进行动物体重测量及临床观察,并做好记录。
当进行LLNA测试时,每组通常至少包含4只小鼠;当只有一个剂量可供评估时,每组至少含5只小鼠。淋巴结反应可以通过测量个体或汇集的淋巴结样品来确定。
4. 细胞增殖测定
淋巴结中的增殖细胞可标记放射性或荧光标记物。常用的放射性标记为3H-甲基胸苷和125I-碘脱氧尿苷,对于荧光可使用氟脱氧尿苷。在LLNA最后一次处理后(72±2)h,记录小鼠体重并静脉注射标记物用于细胞增殖测定。在注射标记物后(5±0.75)h对小鼠实施安乐死,去除引流的耳廓淋巴结。用200μm不锈钢丝网或尼龙网轻轻按压淋巴结来制备单细胞制剂,通过离心将细胞制备物洗涤两次并重悬于PBS中。细胞用5%三氯乙酸(TCA)在(4±2)℃下沉淀(18±1)h。离心后,将沉淀重悬于1ml TCA中,并转移至含有10ml闪烁液的闪烁瓶中进行3H计数,或直接转移至γ计数器进行125I计数。
5. 结果和讨论
以每小鼠每分钟计数(cpm /小鼠)测量淋巴结细胞中的放射性水平。将每分钟计数(cpm)转换为每分钟衰变(dpm)。计算每组小鼠的cpm或dpm的平均值和标准偏差,从每个结果中减去背景值,并确定刺激指数(SI)。三个及以上测试样本的SI≥3,则被认为是阳性。
豚鼠最大限度法(GPMT)
1. 样本和动物准备
测试样本应按照标准附录A进行制备,在不影响测试结果的前提下尽可能使用最高浓度。测试动物应使用体重为300-500克、单一远交系的健康成年白化豚鼠,或是未经产或未怀孕的雌性豚鼠。
试验组豚鼠数量至少为10只,对照组至少为5只。如果存在不明确的反应或不确定结果,则对至少20只测试动物和10只对照动物进行新的研究。动物选择和饲养需满足ISO 10993-2标准要求。
2. 测试过程
在开展主测试前,应进行初步试验,其目的是确定主试验中的试样浓度。将一系列稀释的测试样品局部应用于动物侧腹(至少三只),24小时后取出封闭敷料和贴剂,并使用下表中给出的分级标准评估应用部位的红斑和水肿。对于主测试中的局部诱导阶段,选择导致轻度至中度红斑的最高浓度;对于主测试中的激发阶段,选择不产生红斑的最高浓度。

皮内诱导阶段
如下图所示,在肩胛内区域,对每只动物进行0.1ml皮内注射。位点A:弗氏完全佐剂与所选溶剂按体积比1:1混合成稳定乳液。位点B:试验样品(未稀释的提取物);用溶剂注射对照动物。位点C:将位点B使用的浓度的测试样品,与弗氏完全佐剂按体积比1:1混合成稳定乳液;向对照动物注射空白液体与佐剂的乳液。
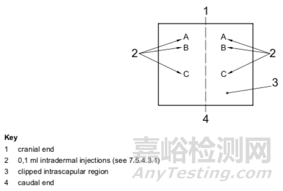
局部诱导阶段
在皮内诱导阶段完成后(7±1)天,在每只动物的肩胛内区域,局部使用约8cm2的贴片(滤纸或吸收性纱布)给予测试样品。使用皮内诱导期中选择的浓度用于B点,若达到的最大浓度不产生刺激,则用10%十二烷基硫酸钠按摩皮肤预处理该区域(24±2)h。使用封闭敷料固定贴片,(48±2)h后取下敷料和贴剂。
激发阶段
在局部诱导阶段完成后(14±1)天,通过局部施用将试验样品和空白置于诱导期未处理的部位,例如每只动物的上腹部,使用位点C选择的浓度将贴片浸泡在试验样品中。采用封闭式敷料固定,(24±2)h后取下敷料和贴剂。
3. 动物观察
在去除敷料后,在全光谱光线下,观察试验组和对照组动物(24±2)h和(48±2)h的激发皮肤部位的外观。并对每个部位和每个时间间隔的进行分级,描述和评定皮肤对红斑和水肿的反应。
4. 结果评估
如果对照组等级小于1,试验组等级大于等于1则为致敏。如果对照徐等级大于等于1,试验组超过对照组中最严重的反应则为致敏;如果出现疑似反应,应进行再激发已确认首次激发结果。
豚鼠局部封闭敷贴法(Buehler Test)
1. 样本和动物准备
该部分的要求与“三.1”保持一致。
2. 测试过程
对于所有局部应用的产品,用测试材料或提取物使适当尺寸的贴剂(滤纸或吸收性纱布)饱和,并将贴剂施加到封闭敷料下的剔除毛发区域(6±0.5)h。在开展主测试前,同样应进行初步试验,使用适当的贴剂将四种浓度的测试样品局部给与动物的侧腹(至少三只)。在(6±0.5)h后取出封闭敷料和贴剂,在贴剂去除后(24±2)h和(48±2)h评估应用部位的红斑和水肿,选择:a)对于诱导阶段,不引起轻微红斑的最高浓度;b)对于激发阶段,不产生红斑最高浓度。
诱导阶段
将贴剂浸泡在一定浓度的测试样品中,施用于每只动物的左上背部区域,在(6±0.5)h后取下,执行此程序的频率为每周三天,并为期三周。同时使用空白液体作为对照。
激发阶段
在最后一次诱导后(14±1)d,用测试样品激发所有测试和对照动物。将贴剂浸泡在一定浓度的测试样品中,通过单次局部施用,将测试样品施用于每只动物的剪切的未测试区域。在(6±0.5)h后取下限制器和封闭敷料和贴剂。
3. 动物观察
在初次或再次激发后(24±2)h,使用表4对测试部位进行分级。在去除激发贴片后(48±2)小时重复分级。在自然光谱或全光谱照明下,观察皮肤反应。
4. 结果评估
如果对照组等级小于1,试验组等级大于等于1则为致敏。如果对照徐等级大于等于1,试验组超过对照组中最严重的反应则为致敏;如果出现疑似反应,应进行再激发已确认首次激发结果。
参考资料:
[1] ISO 10993-10:2010 Biological evaluation of medical devices -- Part 10: Tests for irritation and skin sensitization

来源:启升资讯


