您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-07-30 15:45
摘要:
目的:为完善药物临床试验注册核查工作提供参考。
方法:统计2024 年湖南省药品监督管理局药品审核查验中心完成药品注册联合核查任务(生物等效性试验、新药临床试验)中临床试验机构的有关情况,梳理出现场核查过程存在问题,分析原因并给出建议。
结果:完成对临床试验机构核查任务39 个,发现问题246 个,存在问题集中在临床试验数据记录和报告、安全性信息处理与报告、受试者筛选入组及方案执行这几个方面。
结论:建议临床试验机构加强人才培养,完善质量体系建设,利用信息化系统实现管理增效和数据互通;建议监管部门做好检查员的管理,探索同级核查部门跨区域联合检查、交叉检查的工作模式,强化检查员自身能力建设。
药物临床试验是指以药品上市注册为目的,为确定药物安全性与有效性在人体开展的药物研究,分为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期临床试验以及生物等效性试验[1],是药品上市注册中的关键环节之一。为保证试验数据的真实性、有效性和受试者的安全,国家药品监督管理局启动对药物临床试验现场核查工作,于2020 年7 月1 日施行《药品注册管理办法》《药物临床试验质量管理规范》,对试验全过程的质量控制、各相关方的职责要求作出规定。为了细化明确药品注册核查实施过程中的具体流程、时限、核查关键点及要求,规范药品注册生产现场核查和上市前药品生产质量管理规范检查衔接工作,国家药品监督管理局食品药品审核查验中心于2021 年12 月20 日发布《药品注册核查工作程序(试行)》《药品注册核查要点与判定原则(药理毒理学研究)(试行)》《药品注册核查要点与判定原则(药物临床试验)(试行)》《药品注册核查要点与判定原则(药学研制和生产现场)(试行)》《药品注册生产现场核查和上市前药品生产质量管理规范检查衔接工作程序(试行)》5 个文件。其中《药品注册核查要点与判定原则(药物临床试验)(试行)》对注册核查的目的、范围、临床试验部分现场核查要点(临床试验许可与条件、伦理审查、临床试验实施过程、试验用药品管理、生物样品管理、中心实验室及独立评估机构、临床试验数据采集与管理、委托研究)、生物样品分析部分现场核查要点(生物样品分析条件与合规性、生物样品分析实验的实施、记录的管理)、核查结果判定原则这5 个方面作出规定[2]。疫情期间,为统筹做好疫情防控和促进医药企业复工复产,根据《国家药监局综合司关于新冠肺炎疫情防控期间做好药品注册核查工作的通知》(药监综药注[2020]15 号)的部署,国家药品监督管理局核查中心启动药品注册联合核查相关工作,各省级药品监督管理局协助组织实施核查任务。本文统计了2024 年湖南省药品监督管理局药品审核查验中心完成药品注册联合核查任务(生物等效性试验、新药临床试验)中临床试验机构的有关情况,梳理出在临床试验数据现场核查过程存在的问题并进行原因分析,为临床试验的开展和监管,以及药品注册联合核查的具体实施提出建议和思考。
1、基本情况
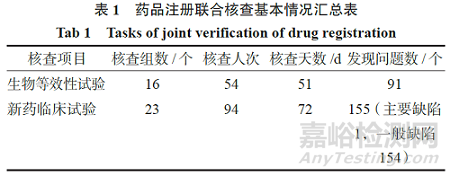
2024 年,已完成对临床试验机构的药品注册联合核查任务(生物等效性试验、新药临床试验)39 个,派出核查组39 个,共148 人次,核查共计123 d,发现问题246 个。其中生物等效性试验已完成核查16 个,现场核查结论均为“建议通过”;新药临床试验已完成核查23 个,现场核查结论:22 个品种为“通过”,1 个品种为“通过,但存在需审评重点关注的问题”(该项为省局审核后结论)。核查基本情况详见表1。
2、缺陷情况
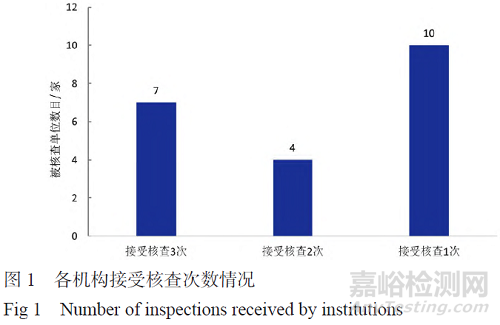
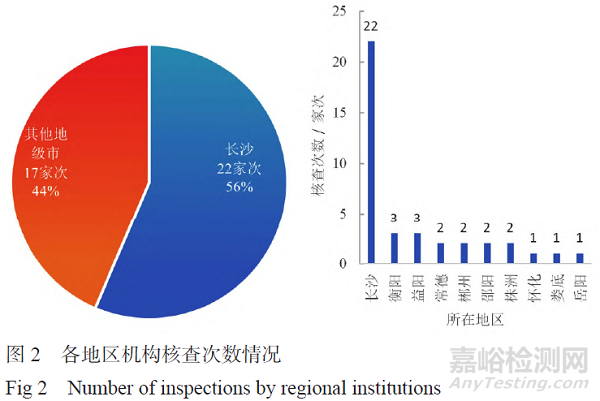
2024 年完成临床试验机构核查涉及21 家临床试验机构,各机构接受核查次数情况见图1,各地区机构核查次数情况见图2。
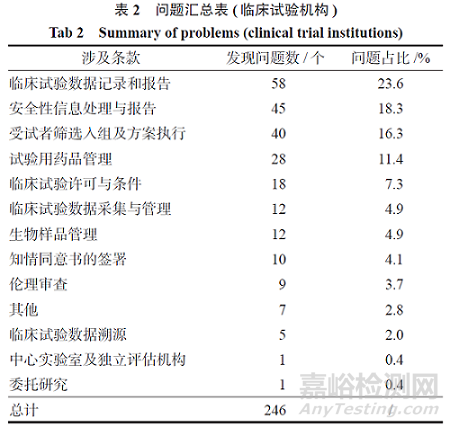
将所有发现问题归属到《药品注册核查要点与判定原则(药物临床试验)(试行)》各个条款,具体情况见表2。发现问题前三项为临床试验数据记录和报告、安全性信息处理与报告、受试者筛选入组及方案执行。
2.1 临床试验数据记录和报告
临床试验数据记录和报告问题主要包括:①不良事件(AE)或严重不良事件(SAE)漏记;② 病例报告表漏记或误记;③ 源文件书写不规范或错误;④ 数据修改不规范或未注明修改理由;⑤ 病例报告表、源数据、病例报告表、数据库及申报资料之间数据不一致。
第⑤项问题为本年度出现的唯一一个主要缺陷)。现场核查4 例受试者相关研究资料,发现4例次原始数据与电子数据采集系统(EDC)数据不一致。因涉及占有一定比例受试者的试验数据不一致,可能损害试验的真实性和可靠性,故省局将核查组判定的该项一般缺陷上升为主要缺陷,现场核查结论由“通过”改为“通过,但存在需审评重点关注的问题”。
2.2 安全性信息处理与报告
安全性信息处理与报告问题主要包括:①AE 或SAE 与药物相关性判定依据不足;② SAE上报不及时、报告表填写信息不全或随访不完整;③ 死亡事件未报告或上报不及时;④ 可疑且非预期严重不良反应及其他安全性报告上报不及时,伦理审查不充分。
2.3 受试者筛选入组及方案执行
受试者筛选入组及方案执行问题主要包括:① 方案偏离漏记;② 合并用药漏记;③ 受试者违反入排标准入组,或未保留足够的支持性证据表明受试者是否符合入排标准。
3 原因分析
3.1 临床试验人才缺乏,人员素质不高
研究者开展药物临床试验积极性有限,对GCP 知识培训不够,未充分理解临床试验与常规临床工作的区别,未认识到临床试验的未知性、风险性和复杂性。个别PI 项目太多难以兼顾,对临床试验投入精力不足,将试验的监督工作完全委托给其他研究人员,造成试验质量失去控制[3]。而新备案机构研究人员经验不足、缺乏团队合作和风险把控能力[4],有些仅对临床试验门诊/ 住院病历、检验报告单等签字,未对知情同意、筛选、随访、质控、AE 报告、病历记录等重要的环节深度参与。
3.2 临床试验机构对质量管理未引起足够重视
未配备足够的临床试验质量管理人员,未建立完善的管理制度和标准操作规程,未按照质控计划开展质量检查,对质控中发现的问题,未要求研究人员进行整改,也未对整改情况进行跟踪[5]。
3.3 临床试验机构对试验硬件投入有待加强
个别机构受场地、资金、人员等限制,医疗资源一般都优先于常规患者使用,就会出现以下情形,如:Ⅰ期临床试验病房床位数不足、无专门的抢救室或抢救设施几个科室共用、机构办专职人员过少、中心药房或资料室无相对独立的空间等。
3.4 信息化系统在临床试验中的运用存在漏洞
信息化系统,如:医院信息系统(HIS)、实验室信息管理系统(LIS)、医学影像存档与通信系统(PACS),缺乏更新和升级、验证报告不完善、或未运用到临床试验当中。另外,各机构间信息化系统未互通共享,在现场核查中对于受试者既往病史,在外院就诊的信息往往仅能查看到研究者问诊记录或受试者提供的外院就诊记录不全,无法溯源。
3.5 GCP 法律法规执行落实不严
现行法律法规在存在执行不严格的情况,对违规行为的处罚力度也不够。如:国家药品监督管理局食品药品审核查验中心于2023 年11 月3日发布《药物临床试验机构监督检查要点及判定原则(试行)》中规定:研究者具有高级职称,参加过3 个以上药物临床试验[6]。该项为关键项目,不符合要求判为严重缺陷。但在检查中发现,部分新备案PI 参加的临床试验非注册类项目,或与备案专业相关性不够,或未能全程参与且有独立完成临床试验的能力,这就体现了机构对PI 的资质要求审核不严。而对于这一检查项目的判定,不同的检查组和检查员之间没有统一的认识,就容易造成意见分歧,结论误判的后果。
4 工作建议
4.1 临床试验机构
4.1.1 加强临床试验人才培养
临床试验机构应配备专职人员来管理临床试验;制定并执行严格的PI 准入制度;积极组织开展培训,内容包括:GCP 及相关法规、体系文件、药物临床试验技术、案例这几个方面[5]。研究人员应增强对临床试验工作的责任感和法律意识,保障上市药物的安全有效及受试者的权益。
4.1.2 完善质量体系建设,试验全程质控管理
第一,应建立能满足临床试验实际工作需要的管理制度、标准操作规程、应急预案等体系文件,使工作做到“有章可循,有据可依”;第二,在试验进行过程中,应不断更新完善体系文件,使质量管理全程全方位、职责清晰易于执行、记录完整及时准确;第三,对于发现的问题,应采取整改、补救措施,问题重大的还要求重新试验、剔除数据、上报相关部门,同时应开展调查分析,及时调整试验方案,防微杜渐。
4.1.3 利用信息化系统,实现管理增效和数据互通
目前已有多家机构实现在自主开发或引进试验信息化管理系统与医院 HIS、LIS、PACS 系统等对接,并可在系统中制定质控计划、设置提醒、记录质控问题,质控结束可在系统中填写发现的问题,研究者可在线完成整改和反馈。但涉及多中心的临床试验,尤其是国际多中心,各参与机构往往各自开展试验,缺少交流和协作,可设置信息化交流平台,各机构和研究者可对试验的操作规程、安全性信息更新、质控问题等进行交流[7]。还可以通过信息化系统将各机构之间的就诊用药检查等原始数据互通,那么受试者参与试验期间筛选入组、病史、合并用药或治疗等涉及的数据就均可溯源。信息化系统可集成记录、监查、备份功能,为临床研究提供了高质量、高效率的工作工具,将研究者从烦琐的手工记录中解放出来[8]。
在信息化带来便捷高效管理的同时,也应关注电子记录存在的潜在风险,系统需经过验证,采取访问控制、权限分配、审计追踪、授权更改、电子签名等手段来保证临床试验数据的准确、完整、安全、保密。
4.2 监管部门
4.2.1 做好检查员的管理工作
参与GCP 核查的检查员来自于药监系统相关部门及直属单位(简称系统内检查员)和临床试验机构(简称系统外检查员)。监管部门应根据核查需求建立全职GCP 核查人员梯队,明确国家药品监督管理局人员及各省局人员在 GCP 核查过程中的构成及职责划分。建立核查人员能力培养体系,保证新聘核查人员的能力达到要求[9]。系统内检查员偏重于药品监管,临床知识方面较薄弱,建议将专职检查员派往机构对试验设计、临床诊断、伦理审查、数据溯源、医院管理流程、信息化系统开展全方位跟班学习。针对系统内兼职检查员因本职工作繁重,无法安排时间参与检查的问题,建议通过表彰奖励、考核加分、参加培训学习等方式来调动其参加核查的积极性。
2024 年我省药品注册联合核查任务均由系统外检查员担任组长,且每组仅有1 名系统内检查员,故系统外检查员的业务能力、法律责任意识、工作作风对核查工作尤为重要。省局应协助国家核查中心在专业技能培训、政策法规宣贯、廉政教育等方面做好系统外检查员的管理工作。
监管部门可通过评估核查报告的质量、抽调检查员的响应度、核查期间请假情况等,对检查员的检查水平和履职配合度进行考察。同时应建立更加完善的检查员信息库,明确各检查员的专业特色,根据核查项目中的病例数目和所属专业来合理安排核查人数和时长,根据专业来抽调专业对口的检查员。
4.2.2 同级核查部门开展跨区域联合检查、交叉检查
2024 年我省GCP 核查任务量较去年增长了96.8%,核查人次增长了145.3%,所有现场核查结论均为通过(其中1 个核查项目现场核查结论为“通过”,经省局审核后改为“通过,但存在需审评重点关注的问题”)。面对任务激增,人员缺乏,核查发现问题总体质量不高,可能存在各机构检查员之间相互关照的风险,建议各省同级核查部门跨区域协作,开展联合检查或交叉检查。
4.2.3 强化检查员自身能力建设
“基于风险”的核査启动模式是监管机构根据当前产业发展实际,加之匹配有限注册核查资源所采取的监管方式。监管力度与风险程度相适宜有利于提高注册核查的针对性和效能[10]。检查员在核查过程中应不断提高风险识别、风险评估的能力,把握风险点,对于风险防控措施能给出建议。例如对于生物等效性试验临床研究部分而言,临床试验合规性、受试者及管理、试验用药物及管理、生物样本采集及管理是注册核查关键点[11]。临床试验涉及多学科交叉,检查员除了掌握各项法规、技能和知识外,还应注重培养交流沟通能力,关注医药前沿领域的发展和创新[12]。
参考文献
[1] 国家市场监督管理总局. 药品注册管理办法[EB/OL].(2020-01-22)[2025-01-02]. https://www. samr. gov.cn/zw/zfxxgk/fdzdgknr/fgs/art/2023/art_3275cb2a929d-4c34ac8c0421b2a9c257. html.
[2] 国家药品监督管理局食品药品审核查验中心. 药品注册核查要点与判定原则(药物临床试验)(试行)[EB/OL].(2021-12-20)[2025-01-02]. https://www. cfdi. org. cn/cfdi/resource/news/14200. html.
[3] 王佳楠,钱雪,李见明. 药物临床试验数据核查工作及常见问题分析[J]. 中国新药杂志,2018,27(11):1273-1276.
[4] 张娟利,刘美佑,樊婷婷,等. 陕西省药物临床试验机构现状分析[J]. 中南药学,2024,22(2):548-552.
[5] 高荣,宁靖,王安娜,等. 从药物临床试验数据核查看药物临床试验机构的职责履行情况[J]. 中国新药杂志,2019,28(20):2518-2523.
[6] 国家药品监督管理局食品药品审核查验中心. 药物临床试验机构监督检查要点及判定原则(试行)[EB/OL].(2023-11-03)[2025-01-02]. https://www. cfdi. org. cn/cfdi/resource/news/15689. html.
[7] 曹丽亚,郭薇,谢林利,等. 药物临床试验机构对临床试验项目质量控制工作的实践与思考[J]. 中国药师,2020,23(4):713-715.
[8] 陈元璐,谢朋飞,崔宏娣,等. 药物早期临床试验信息化建设应用与实践[J]. 中南药学,2023,21(9):2519-2524.
[9] 中国外商投资企业协会药品研制和开发行业委员会,中国药学会药物临床评价研究专业委员会,北京大学亚太经合组织监管科学卓越中心,等. 改善中国临床研究监管体系的几点建议[J]. 中国新药杂志,2018,27(11):1217-1224.
[10] 何辉,刘艺迪,周刚. 监管科学视角下基于风险启动药品注册临床试验现场核查的新思考[J]. 中国新药杂志,2024,33(8):756-760.
[11] 张正付,秦婷,李萌. 生物等效性试验的重要环节和注册核查关键点[J]. 中国临床药理学杂志,2020,36(18):2943-2946.
[12] 吴方,于倩,王康冉,等. 欧盟临床检查员职业化制度的经验与启示[J]. 中国新药与临床杂志,2020,39(7):406-410.

来源:中南药学/喻亮宇


