您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-19 08:14
在2022年11月,由RDPAC 的药学团队对中美欧药学技术指导原则和指南进行了调研与对比,总结分析了中美欧指南的标准差异及实施情况差异,采用了主题词及分类方式、深度对比、报告撰写和定稿流程,最后呈现研究报告,给到药审中心参考。
欧美与中国一样也针对 CMC、质量和 GMP 设立一系列的法规,包括法律,管理办法,指导原则。EMA 和 FDA 均会在官网上提供法律法规、管理办法和指导原则的链接,并指明其生效状态是征求意见稿,正式版还是其他状态。如:在欧洲指导原则被废止时会被保留在网站上 并明确说明其为已废止的状态,有助于使行业能明确的了解现行的指南情况。
在美国,FDA 也会发布 CMC 相关的法规及程序手册(CMC related Manuals of Policies and Procedures,MAPPs),包含联邦指令和内部行政程序文件。CMC 指导原则由药品审评研究中心(CDER)或生物审评研究中心(CBER)撰写。CDER 和 CBER 每年都会发布包含 CMC 和 GMP 在内的指导原则年度制定计划。
EMA 有三个常设工作组负责制定 CMC 和 GMP 指南 : 质量工作组 (QWP)、生物工作组 (BWP) 和检查员工作组 (IWG)。这些工作组也会公布年度工作计划。EMA 对于指导原则的撰写,如文件 Procedure For European Union Guidelines And Related Documents Within The Pharmaceutical Legislative Framework 所述,EMA 会根据情况收集所有成员国、欧洲药典、行业协会及欧洲外监管机构国家的建议,形成文件。除了指南,EMA 还会发布回顾报告 (reflection paper) 和问答文件 (Q&A),详细阐述当局对特定话题的观点。这些文件的发布流程相对于指南更快和灵活,具体发布什么类型的文件取决于相关题目的范围和话题的现阶段知识 的成熟度。
指南草案通常会在 3 至 6 个月内发布并征求意见 ( 有些情况下可能会允许更多的时间 )。 在审核相关意见后,EMA 和 FDA 将发布最终版本。关于指南的评论和回答也通常会被发布。
ICH Q 系列文件一旦被采纳实施,EMA 和 FDA 都会将实施结果公示。重要的 ICH 文件会被在后续的当局文件中被引用,或作为 EMA 或 FDA 的指导文件发布。通常情况下,当新的 ICH 质量指南被制定时,EMA 和 FDA 都会删除关于同一主题的现有本国指南。如原指南包含 ICH 之外的内容,则将原指南相关部分摘出,重新发布。结合欧美经验,为了进一步提升我国的药学指南体系,现提出如下建议:
1. 构建我们指南全生命周期的维护机制
可参考 EMA 指南维护机制,基于监管和工业界实际情况,建立并公布年度起草修订计划。 对于前沿性议题可从 Q&A 文件和回顾指导文件 (reflection paper) 的撰写起步,逐步完善,最终形成较全面的指南文件。对于已有指南文件的废止和修订可参考下述几点:
(1)颁布指南(尤其是ICH类)时,同时明确废止既往与之不一致的相关指南:相关指南可仍保留于现行网站上,但应明确声明其废止或明确适用版本。使得行业能更清楚应该遵从 哪些现行的指南,来指导其研发。
(2)建议将现行的文件分类梳理公示:可参考本文推荐的关键词,对于现行的法规、公告、 指南等文件按照申报资料 CTD 格式的章节及特殊产品类别,进行分类梳理,使行业对监管部 门的最新要求更明确。
(3)建议展示指南更新的连续性:对于同一指南的更新,建议不更新指南名字,并提供 新旧版的花脸稿,让行业能更快了解变更内容。例如,欧洲对变更的变更指南的更新维护方式, 公布更新日期,并同时更新花脸稿:Heads of Medicines Agencies: Variation (hma.eu)
(4)每年征求业界的建议,包含指南撰与建议和实施情况
2、指南要求应明确具体,术语规范
在指南的撰写过程中,建议与行业沟通交流,使指南的语言更加的具体明确,尽量避免摸棱两可的词汇,从而使指南的指导性更强,减少后期不必要的重复沟通和交流。对于关键要求, 建议明确具体的接受限度。
3、指南实施定位具有灵活性
一般情况下,研发均应参考指南的相应要求。在特殊情况下,当该指南不适用时,应允许申请人基于科学进行不同于指南要求的研究。当其结果可以证明产品安全有效和质量可控时, 应给与批准。
4、关于技术上的额外要求以指南形式公示并进行培训
如在某些技术问题上,相较于全球主要监管机构,药审中心有额外要求的,建议以指南的形式公示出来并给予培训,让行业对申报要求更清晰,并可以提前准备。
5、征求意见稿公示的反馈时间建议延长至3-6个月
建议在正式文件实施后递交的申请才按照新的指南要求。对于任何一个新申请或变更,行业通常都需要在递交前 1-2 年进行准备,所以很难短时间内补充研究资料和更改递交资料。
推荐废止的药学部分指导原则清单
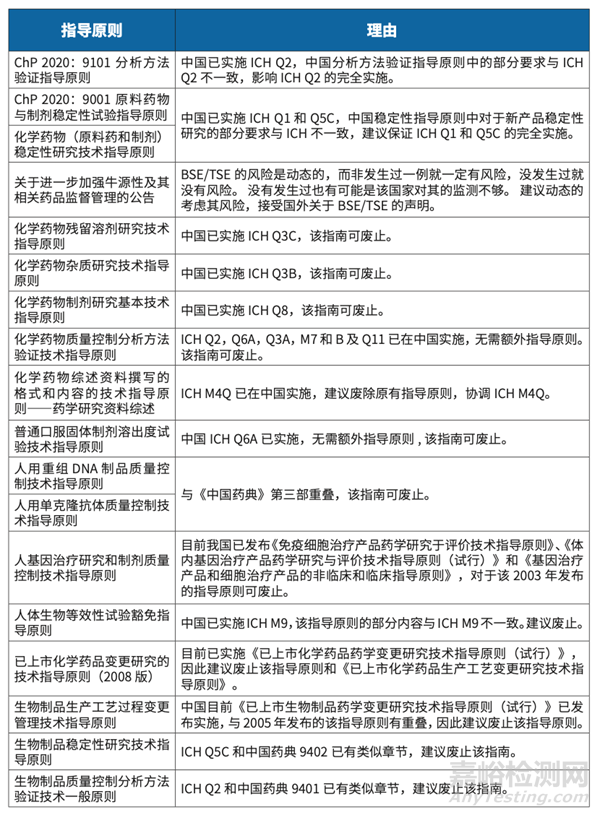
参考文献
1.国内外药品技术指导原则体系对比研究 (药学部分》,国家药品监督管理局药品审评中心,中国药品监督管理研究会,药品监管研究国际交流专业委员会,中国外商投资企业协会药品研制和开发工作委员会(RDPAC),2022年11月

来源:文亮频道


