您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-03-19 11:41
正电子发射磁共振成像系统(Imaging system of positron emission and magnetic resonance imaging,本文简称PET/MR)(以下简称PET/MR),PET/MR系统根据产品结构形式不同,可分为分体式、PET插入式、完全集成式。
参照现行《医疗器械分类目录》,该类产品分类编码为06-17-03,管理类别为第三类。
一、正电子发射磁共振成像系统的结构组成与适用范围
1、结构组成
PET/MR一般由正电子发射断层扫描(PET)子系统(包括PET探测器)、磁共振成像(MR)子系统(包括超导磁体、梯度功率放大器、梯度线圈、射频功率放大器、射频线圈、谱仪)、检查床、激光灯、工作站、配电系统及生理信号门控单元组成。PET/MR系统扫描架内部结构图见图1
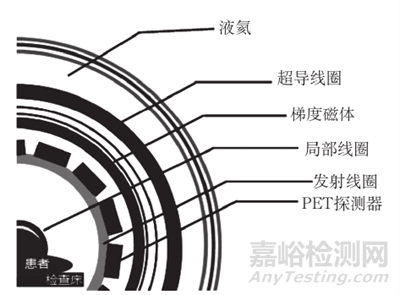
图1 PET/MR系统扫描架内部结构图示例
2、产品适用范围
PET/MR系统提供生理和解剖信息的配准与融合,临床常用于神经系统、心血管系统疾病和肿瘤的影像学检查及评估。该系统PET或MR可以单独成像。
二、正电子发射磁共振成像系统的主要风险
产品风险管理资料应符合GB/T 42062《医疗器械风险管理对医疗器械的应用》。
针对PET/MR产品的安全特征,从能量危险(源)、生物学和化学危险(源)、操作危险(源)、信息危险(源)等方面,对产品风险进行全面分析。PET/MR产品可能危险(源)示例如下:
表1 PET/MR产品的主要危险(源)
| 危害分类 | 危害二级分类 | 危害示例 | 可预见的事件序列 | 危害处境 | 损害 |
| 能量危害 | 电击危害 | 应用部分或可触及导电部分漏电流超出范围 | 病人或操作者直接接触器械的应用部分或可触及导电部分 | 病人或操作者受到电击 | 惊吓、可逆转的电击伤、不可逆转的电击伤、死亡 |
| 系统安装不良、部件更换不当(如:保护接地不当) | 保护接地与基本绝缘同时失效 | 病人或操作者受到电击 | 惊吓、可逆转的电击伤、不可逆转的电击伤、死亡 | ||
| 系统工作电压暴露 | 系统外壳被打开情况下,设备持续工作。 | 病人或操作者受到电击 | 惊吓、可逆转的电击伤、不可逆转的电击伤、死亡 | ||
| 环境湿度超出设备正常工作许可范围 | 系统绝缘隔离失效、被击穿 | 病人或操作者受到电击 | 惊吓、可逆转的电击伤、不可逆转的电击伤、死亡 | ||
| 液体溢流造成短路 | 注射药物泄漏造成液体溢流。 | 病人或操作者受到电击 | 惊吓、可逆转的电击伤、不可逆转的电击伤、死亡 | ||
| 热能造成灼伤或火灾 | 可触及表面过热 | 病人或操作者直接接触过热表面 | 病人或操作者受到烫伤 | 惊吓、可逆转的烫伤、不可逆转的烫伤 | |
| 组件失效、结构破坏导致的热液泄露、飞溅 | 热油从扫描架泄漏 | 病人或操作者受到烫伤 | 惊吓、可逆转的烫伤、不可逆转的烫伤 | ||
| 系统组件燃烧 | 系统部件超温 | 部件温度超过材料燃点 | 火灾 | ||
| 机械损害 | 零部件松动、脱出主机 | 设备旋转部分紧固件机械松动 | 旋转过程中,零部件脱出主机 | 惊吓、可逆转的击伤、不可逆转的击伤、死亡 | |
| 运动部件失控及非预期运动 | 运动控制部件被持续触发 | 运动部件持续运行超出行程范围 | 撞击、拉伤病人 | ||
| 设备翻倒与滑动 | 设备受到外力推动 | 设备翻倒 | 撞击、压倒病人 | ||
| 患者从支撑装置上跌落 | 较重的病人使用支撑装置 | 支撑装置翻倒 | 撞击、摔伤病人 | ||
| 非电离辐射 | 患者支撑错误运动,病人摆位不当,导致重新扫描 | 患者支撑错误运动 | 成像部位偏差 | 患者接受无益电磁辐射 | |
| 门控或触发延时或不能触发 | 使用未经授权的门控部件 | 门控延时错误 | 患者接受无益电磁辐射 | ||
| RF场导致灼伤 | 1)RF电流流过病人或附近的闭合导体环路 | 使用者进入杂散射频场暴露区 | 患者灼伤 | ||
|
2)接收线圈与发射场耦合,大电场产生的局部热区 |
|||||
| 3)接收线圈电缆与接头接触不良,有源去耦电路失效 | |||||
| 感兴趣区域控制不准确,部分成像或不能成像 | 定位位置偏差 | 实际成像区域,偏离所定位的感兴趣区域 | 病人接受无益电磁辐射 | ||
| 磁能 | 磁力作用下铁磁成分危及人体组织或医疗设备 | 患者携带设备和或体内植入金属异物 | 强磁场造成人身损伤 | 患者受伤、死亡 | |
| 声能 | 梯度线圈电流受磁场力作用产生噪声 | 噪声太大 | 患者听力受到噪声刺激 | 患者听力损伤 | |
| 其它能量伤害 | 激光对患者、操作者的视觉伤害 | 患者、操作者对激光危害认识不足 | 患者、操作者视网膜受到激光照射 | 患者视觉损伤 | |
| 磁体冷却剂对维护人员的低温伤害 | 维护人员没有穿戴保护装置直接接触低温物质 | 维护人员被低温物质灼伤皮肤 | 维护人员皮肤灼伤 | ||
| 生物和化学危害 | 生物相容性危害 | 可接触部件生物相容性问题 | 患者接触生物不相容材料 | 患者与生物不相容材料接触 | 皮肤过敏 |
| 交叉感染危害 | 接触患者的部分可能造成交叉感染 | 设备清洁不当 | 患者、操作者接触到传染性病菌 | 交叉感染 | |
| 运行中的危害 | 设备功能的丧失或变坏 | 设备校准错误造成的危害 | 设备校准错误 | 设备损坏 | 设备可得性受损 |
| 影像重建或后处理过程导致的伪影 | 设备故障造成伪影 | 设备故障 | 影像质量降低、设备可得性受损 | ||
| PET像与MR影像的配准错误 | 校准过程未正确执行 | 设备校准不当 | 影像质量降低 | ||
| 通信故障导致操作员无法听到患者声音 | 患者通信模块失效 | 使用者与患者失去联络 | 精神紧张 | ||
| 设备误用造成的危害 | 病人人口数据、扫描参数、几何参数设置错误,导致伪影或影像质量下降 | 病人参数输入错误,导致算法使用错误数据 | 病人影像存在伪影、影像质量下降 | 影像质量下降 | |
| 软件安装错误、文件系统崩溃 | 软件错误造成系统崩溃 | 数据丢失 | 重新进行扫描 | ||
| 定位激光校准错误造成穿刺位置偏差 | 激光校准错误 | 穿刺位置偏差 | 诊断、治疗准确性下降 | ||
| 注射参数设置错误导致的不当注射 | 使用者输入错误的注射参数 | 注册参数超出正常范围 | 病人机能受损 | ||
| 设备与未经批准的门控设备联用 | 设备与不兼容的门控设备联用 | 门控设备误触发或不触发 | 病人重复进行扫描 | ||
| 环境危害 | 电磁场 | 设备工作时未采取达到符合要求的磁屏蔽措施 | 工作场地磁屏蔽不符合要求 | 对其他设备和环境产生电磁干扰;系统受外界电磁干扰,产生干扰图像,不能用于诊断 | 诊断准确性下降 |
| 储存危害 | 系统在非预期环境下储存和运行 | 储存或运行偏离预定的环境条件 | 设备性能下降 | 诊断准确性下降 | |
| 信息系统、网络安全导致的危害 | 网络安全导致性能受损 | 病毒、恶意软件在介入过程中造成成像延迟 | 恶意软件干扰器械正常使用 | 用于介入时影像延迟 | 介入过程受干扰,病人机能受损 |
| 临床误判危害 | 影像数据错误造成的危害 | PET的SUV值计算错误 | 校准过程未正确执行 | 设备校准不当 | 影像数据错误,误诊,漏诊 |
| 影像质量降低造成的危害 | 图像伪影 | 日常维护未正确执行 | 设备维护不当 | 影像质量降低,误诊,漏诊 | |
| 影像被错误理解的危害 | 影像标记不全 | 使用者错误理解影像上病人身体方位 | 病人身体左右部位错误 | 误诊、误治 |
三、正电子发射磁共振成像系统的相关标准
PET/MR相关适用标准见表2
表2 PET/MR相关适用标准
|
标准编号 |
标准名称 |
适用情况 |
|
GB 9706.1 |
医用电气设备 第1部分:基本安全和基本性能的通用要求 |
适用 |
|
YY 9706.102 |
医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容要求和试验 |
适用 |
|
YY 9706.233 |
医用电气设备第2-33部分:医疗诊断用磁共振设备的基本安全和基本性能专用要求 |
适用 |
|
GB 7247.1 |
激光产品的安全 第1部分:设备分类、要求 |
有激光产品适用 |
|
YY/T 1719 |
正电子发射断层成像及磁共振成像设备通用技术要求 |
适用 |
|
YY/T 1840 |
医用磁共振成像设备通用技术要求 |
适用 |
|
GB/T 18988.1 |
放射性核素成像设备性能和试验规则第1部分正电子发射断层成像装置 |
IEC标准和NEMA标准选其一适用 |
|
GB/T 25000.51 |
系统与软件工程系统与软件质量要求和评价(SQuaRE)第51部分:就绪可用软件产品(RUSP)的质量要求和测试细则 |
适用 |
四、正电子发射磁共振成像系统性能研究试验要求
产品性能指标条款可以参照YY/T 1719、YY/T 1840和GB/T 18988.1的相关要求,结合产品特征进行制定。
1、化学和物理性能研究、电气系统安全性研究
开发人需开展产品非临床研究,需明确适用的标准或方法。关于适用标准中的不适用条款,需要明确原因。
开发人需开展产品性能研究,结合产品扫描模式、应用模式、技术特点等,开展相应的测试验证研究。
PET部分需参照PET/CT指导原则和PET/CT指导原则(数字化专用)开展研究。
MR部分需参考MR指导原则开展研究。
PET/MR部分需开展PET/MR兼容性、PET衰减校正、运动校正准确性、图像配准精度等研究。
开展新技术/关键技术的验证确认研究。新技术的设计与实现采用了国际标准或技术规范的,应明确相应名称。若采用了国家标准、行业标准以外的标准或模体进行测试的,应明确相关信息及详细的测试方法。
2、辐射安全研究
通常PET/MR设备本身没有放射性辐射。其辐射来源于注射于病人的放射性核素或者质控、校准使用的放射源,在这种情况下,需要明确如何对辐射进行控制和防护,特别是涉及放射源的情况。
3、软件研究
开发人可以依据《医疗器械软件注册审查指导原则(2022年修订版)》,开展软件研究(含现成软件研究、互操作性研究、GB/T25000.51-2016自测等)。软件研究需覆盖全部软件组件。
开发人需明确软件完整版本的全部字段和字段含义,并确定软件完整版本和发布版本。
若采用深度学习算法等人工智能技术,开发人可以参照《人工智能医疗器械注册审查指导原则》开展相应研究。
开发人可以参照《医疗器械网络安全注册审查指导原则(2022年修订版)》开展网络安全研究。
若适用,按《医疗器械软件注册审查指导原则(2022年修订版)》开展互操作性研究。
4、生物学特性研究
明确产品中与人体接触部件(床面、线圈、绑带、头托等)材料、接触类型。开发人可以依据GB 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》的方法,开展生物学评价研究。
5、清洁和消毒研究
需明确推荐的消毒工艺(方法和参数、消毒频率、消毒介质)以及所推荐清洁消毒方法确定的依据。开展清洁消毒有效性的验证确认研究。
6、动物试验
开发人在产品研制过程中可参照《医疗器械动物试验研究注册审查指导原则第一部分:决策原则》确认是否需要进行动物试验。开展动物试验时需参照《医疗器械动物试验研究技术审查指导原则》(第二部分:实验设计、实施质量保证)相关要求。
通常对于没有PET/MR产品研发经验的全新制造商,在研制第一款PET/MR产品时可以考虑动物试验进行验证。另外,研制产品和已上市同类产品相比发生重大变化时,如:设备采用全新的工作原理和结构设计,属于全新设备,国内市场上没有与之类似的上市设备;设备采用了新的关键器件,该器件具有全新的技术特性,其对设备的应用和操作产生了较大的影响,所获得的影像质量也有很大区别;在原有的基础上开发了新的临床应用领域等情况,可以考虑动物试验进行验证。
动物试验可作为模体试验的补充,例如新算法图像质量的验证和延时成像、快速成像、动态成像、定量成像等功能的验证。
7、稳定性研究
7.1使用稳定性
开发人可以依据《有源医疗器械使用期限注册技术审查指导原则》,开展产品使用期限的研究。
对于某些部件,应单独确定其使用期限。该期限可以与整机相同,也可不同。这些部件包括但不限于:需定期更换的部件、光学/辐射敏感部件、机械磨损部件等(如PET探测器、检查床、磁体、谱仪、射频线圈、梯度线圈、其他电气部件等)。
对于用时间作为寿命评估单位不合适的部件,可进行适合部件本身特性的单独规定。应开展相应部件使用期限的验证研究。
7.2运输稳定性
开发人需开展运输稳定性和包装研究,证明在规定的运输条件下,运输过程中的环境条件不会对医疗器械造成不利影响。
开发人可以参考GB/T 14710等相关标准进行研究。PET/MR 至少应执行GB/T 14710-2009 中关于气候环境的低温存储试验、高温存储试验和湿热存储试验。可携带部件应执行GB/T 14710-2009 中机械环境的振动试验和碰撞试验。也可以采用其他方法或者标准进行研究,但需明确理由。

来源:嘉峪检测网


