随着一致性评价工作的全面展开,相关技术指导原则和质量标准的不断完善,制药行业快速发展,业内对药品质量的研究也更为深入和全面。替米沙坦片作为仿制降压药,在过去十几年,历经不断的质量研究和提升,从溶出度符合限度、溶出曲线与原研制剂相似,发展到生物等效,这是质的飞跃。也侧面反映了我国医药行业的进步和国产药的质量提升。
替米沙坦是特异性血管紧张素Ⅱ受体(AT1 型 ) 拮抗剂,含有双苯并咪唑的芳香烃基团,因此具有较强的脂溶性和组织穿透性。它是血浆半衰期(Half-life)较长的血管紧张素受体阻断剂,抑制效应长达 24 小时,能够保证其较长时间地停留在作用部位,保持活性,达到降低血压的目的。替米沙坦片是由德国勃林格殷格翰(Boehringer Ingelheim)公司研制开发,1998 年在美国上市,于 2002年由 CFDA(国家食品药品监督管理总局)批准进入中国市场。其商品名为 Micardis,规格为 20 mg、40 mg 和80 mg,基于其“强效、长效(半衰期24 小时)、安全” [1] 的特点,增强高血压患者治疗的耐受性。替米沙坦上市后受到了临床医生及广大患者的普遍肯定和接受。之后不断被国内企业仿制,国内现存替米沙坦片有效批准文号已有 50 余个。
中国药企仿制初期,由于不同企业的研发能力、生产水平存在差异,不同厂家仿制的替米沙坦片在药物成分、药品疗效、药物价格等方面,均存在较大差异。在国家药典标准和相关指导原则的不断更新及相关部门的监管下,生产企业逐渐成长,产品质量不断提升,相关的检测手段和评判标准也在不断完善。
2008 年,根据一篇对替米沙坦制剂溶出度研究的文献 [2] 报道,其针对不同厂家的替米沙坦片进行溶出度测定,以水为溶出介质,得到的最低溶出度为 13%、最高溶出度为 92%。这说明当时不同厂家的替米沙坦片质量确实存在差异。
2012 年,罗密等人又以不同厂家的国产替米沙坦片为研究对象 [3],与进口替米沙坦片一同测定溶出曲线。并通过评估国产片与进口片的溶出曲线相似性,对比质量情况。结果显示,f1和 f2 均出现低于标准值的数据,证明国产片与进口片的溶出曲线不相似,质量存在差异。
随着更多分析设备的出现,检测手段更加多元化。有学者通过热重分析法(TG)、差示扫描量热法(DSC)[4]、粉末 X 射线衍射实验,对不同处方和工艺的替米沙坦片进行了初步判断。
Micardis 作为原研制剂,根据专利 [5] 可知其主要制备工艺为喷雾制粒,且在制备中替米沙坦以一种非结晶形式存在。而早期国内的大部分工艺都是湿法制粒。与原研相比,制备工艺差异大,原料晶型研究不充分,制药企业研究水分参差不齐,是长时间以来造成国产制剂与原研制剂质量差异的因素之一。
2015 年,《关于改革药品医疗器械审评审批制度的意见》由国务院印发,预示审评工作正式提上日程。随着一致性评价工作的推进,各大生产企业将更多的资源投入到产品一致性研究中,在产品质量提升的道路上勇往直前。研究的内容也更为全面和深入,涉及原料药的晶型研究、杂质研究、辅料研究、包材研究、制剂处方解析、关键工艺参数研究、质量控制和标准制定、溶出曲线和稳定性研究及生物等效性研究等。这为制药企业提供了完整的研究思路和方向。
至 2023 年 9 月,根据国家药品监督管理局药品审评中心(CDE)官网信息,已有 15 条关于替米沙坦片的受理号通过一致性评价,还有部分生产企业在一致性评价审评的路上。可见对于消极审评的企业,只有被淘汰的命运。
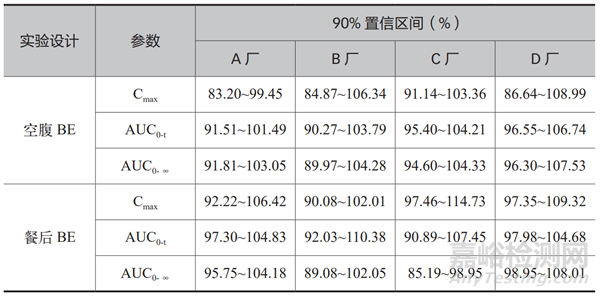
药学等效,不一定生物等效。希望采用一致性评价的方式可以提高药品质量,希望仿制制剂能够实现在药学等效的基础上,服用相同剂量,与原研制剂在活性成分的吸收程度和速度上,具有相同的安全性和有效性,无明显的统计学差异,达到生物等效。在已通过 CDE 的信息中笔者获取到:各生产企业经过充分的药学研究和工艺研究,在 BE(生物等效性)实验中,基于单次实验 32 例 ~50 例受试者参与的基础上,采用“单中心、随机、开放、三周期、三序列、部分重复交叉试验设计空腹和餐后试验”的实验设计方案,或增加“四周期、双制剂”的研究,或采取大规格制剂的 BE 豁免小规格制剂的实验设计策略;等效标准设置为受试制剂和原研制剂药代动力学参数(Cmax、AUC0-t、AUC0-∞)经对数转换后的几何平均值比值的 90%置信区间在 80.00% ~ 125.00% 范围内 [6]。
表1 展示了从 CDE 公开信息中,抽取的几家生产企业关于替米沙坦片40 mg 产品的 BE 数据。由表中数据可以看出,通过一致性评价的国产替米沙坦片,空腹 BE 和餐后 BE 均与原研制剂达到生物等效。一致性评价工作,对替米沙坦片的质量提升是显著的,它为各制药企业树立了产品研究的标杆和目标,也是规范制药行业的标尺。国内制药企业不应仅仅追求溶出曲线层面的药学等效,更应追求生物等效,并且不断完善药物警戒、不良反应监测等工作,最终为广大患者提供可靠且可信的,质量不亚于进口药品的国产产品。
表1 4家生产企业40mg替米沙坦片的 BE 数据
据了解,我国有 5000 多家药厂,其中有很大部分都是仿制药企业 [7],是名副其实的仿制药大国。由点及面,替米沙坦片仅是我国药品体系中的一个小个体,还有更多的企业在面临其他药品的一致性评价挑战。因此,一致性评价工作更是一次制药行业的革命。希望在一致性评价的环境中,我国仿制药的水平可以得到提升,国家标准可以完善,制药行业能够更加有序发展,国产制剂可以更有竞争力,也让更多的患者相信国产好药,认可国产药品,享受更多的实惠。
参考文献
[1] 国家卫生计生委合理用药专家委员会,中国医师协会高血压专业委员会. 高血压合理用药指南 [J/OL].中国医学前沿杂志(电子版),2015,7(06): 22-64.
[2] 郑艳彬,印杰,陆威.不同厂家替米沙坦片的溶出度比较 [J].药学服务与研究,2008 (05):386-387.
[3] 罗密,Bora Lichande,陈芬燕,张毕奎 . 不同厂家替米沙坦片在四种溶出介质中溶出曲线比较:2012年中国药学大会暨第十二届中国药师周论文集[C].北京:中国药学会,2012:1-9.
[4] 李忠红,张玫,樊夏雷,等 . 采用热分析法对替米沙坦口服固体制剂处方工艺的分析 [J].中国药品标准,2014,15(03):171-179.
[5] 贝林格尔英格海姆砝玛两合公司.一种制备基本上非结晶形式的替米沙 坦 的 方 法:CN200810214445.4[P].2002-01-16.
[6] 赵云海 . 马来酸阿伐曲泊帕在中国健康人体内药代动力学和基因组学研究 [D] 郑州:郑州大学,2022.
[7] 张静 . 从仿制药到原研药,我们距离医药强国还有多远?[J]. 中国品牌,2018(09):60-61.
本文作者黄波,天津华津制药有限公司,仅供交流学习。