您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-02-18 10:08
随着药物形式的多样性越来越丰富,涉及光安全性评价的药物也随之增多,光安全性被提及和讨论的频率也有所增加,关注度越来越高。其实,很多药物在光照条件下均可以产生对人体从急性到慢性,从可逆到不可逆的损害。根据损害的特点不同,光安全性评价通常分为四类:光毒性、光过敏性、光遗传毒性和光致癌性评价。其中,光毒性最为常见。本文围绕光安全性评价相关指导原则、开展策略、常见问题等主题展开。
1、常见光毒性药物
有些药物服用后,在光照刺激下,可引起人体过敏,这类药物叫光敏药物。药物致光敏反应的主要表现:在光照皮肤处出现红斑、水肿,同时伴瘙痒、灼痛或出现色素沉着,重者可有水疱,水疱溃破后可形成溃疡或糜烂。
常见光毒性药物包括喹诺酮类抗菌药,代表药物有司帕沙星、氧氟沙星、环丙沙星、洛美沙星。磺胺类抗菌药如四环素类、氯霉素。抗精神病药如氯丙嗪。利尿药如氢氯噻嗪、呋塞米、氨苯蝶啶。降糖药如格列苯脲、格列吡嗪。抗癌药如长春新碱、甲氨蝶呤。
2、光毒性产生机制
涂宏刚等人在《药物光安全性评价的研究进展及评价策略》一文中描述了光毒性产生四种机制。某些药物在接受光照后,由稳定态转为激发态,进而对机体产生损害作用。其一,直接产生毒性的光产物导致细胞损伤;其二、产生激发的单线态氧,氧化生物大分子,导致细胞膜或DNA的损伤;其三、产生超氧化物、过氧化物、羟基等物质损伤细胞膜或DNA;其四、导致药物基团的改变而与生物大分子共价结合,形成抗原,进而产生免疫反应。
3、药物的光毒性研究该如何开展
3.1光毒性研究相关指导原则
2015年1月,FDA发布了药品光安全性试验(photosafety testing)指南(S10)。该指南的目的是推荐药物光安全性试验的国际标准,对该文件的解读可结合ICH M3(R2)第14节有关光安全性评价的内容。
ICH S10: Photosafety evaluation of pharmaceuticals.
在进行光安全性试验时,评估应结合光毒性、光过敏性、光遗传毒性、光致癌性的反应进行。光过敏性是由于药物经过光化学反应产生光产物而引起的免疫反应。在评估中,也会尽可能地利用非动物方法或临床数据来评估光安全性。然而,指导原则并不适用于多肽、蛋白质、抗体偶联物或寡核苷酸类药物,以及对API或辅料有新安全性担忧的产品(除非是对产品的剂型进行了改变)。
国内可参考药物刺激性、过敏性和溶血性研究技术指导原则(2014)中关于光毒性(光刺激性)试验的内容。
3.2光毒性评价的策略
抗肿瘤药物和非抗肿瘤药物,光毒性评价都遵从ICH-S10。
原料不具有紫外线吸收特性通常不需要开展该项试验。但是如何判断“不具有紫外线吸收特性”是个问题。我们知道光谱中紫外线的频率可分为UVA(400nm~320nm)、UVB(320nm~280nm)、UVC(280nm~100nm)、EUV(100nm~10nm),自然界的主要紫外线光源是太阳,太阳光透过大气层时波长短于290nm的紫外线会被大气层中的臭氧吸收掉,因此一般自然阳光的波段在290~700nm,日常接触的紫外线主要是290nm~400nm波段。
根据ICH的规定可通过紫外吸收光谱:1、判断物质在290nm~400nm是否有最大吸收,在这个波长范围内没有明显吸收的物质,通常不具有紫外吸收特性;2、如果物质在290nm~400nm有弱吸收,计算290nm~400nm范围内的摩尔消光系数(MEC)。
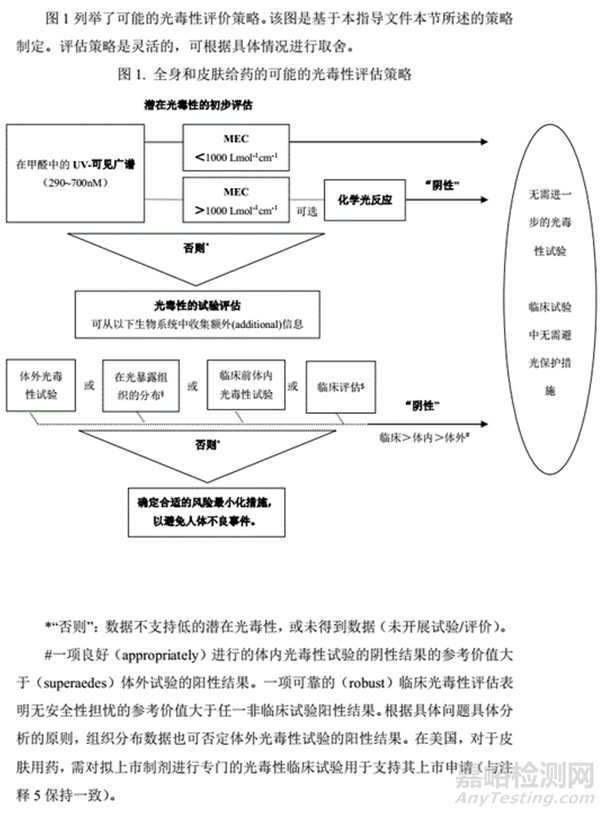
在初始IND时,至少需要通过光化学性质来评估光毒性的潜在可能。考察化合物在290~700nm波长范围内能否吸收光子。ICH S10指出,当化合物在290~700nm波长范围内的摩尔消光系数(MEC)不高于1000L/mol/cm时,认为该化合物不具有足够的光反应性来产生直接的光毒性。如果高于1000L/mol/cm,可以通过非临床组织分布试验结果考察化合物在皮肤、葡萄膜等相关组织中是否有分布。如有,或者在IND申请前没有进行非临床组织分布试验,那么可以在临床研究方案中增加相关避光措施保护受试者。
在OECD TG 432也提到,如果摩尔消光系数(MEC)小于1000L/mol/cm(以甲醇测量),该化学物质不太可能发生光反应,这些化学物质可能不需要光毒性测试。
ICH S10给出的光毒性研究策略流程图如下图所示。首先根据MEC数值鉴别风险,判断药物是否需要进行光毒性试验。如需开展,可先进行基于体外试验系统的研究,一般首选3T3中性红摄取光毒性试验法(3T3 NRU-PT),如果结果为阴性,无需进行进一步研究。如果阳性,则需结合组织分布数据,开展体内光毒性研究。如果体内光毒性结果阳性,则应进行光过敏试验。关于这点,EMA(EMA,2011)和ICH(S10)均认为系统给药的药物不需要进行光过敏评价,而经皮给药的药物需要开展该研究。
3.3 常见光安全性评价方法
光毒性评价方法包括3T3 NRU-PT、红细胞光毒性法、人皮肤模型、Photo-RBC试验、人角化细胞法、人淋巴细胞法等。其中3T3 NRU-PT已经收录进OECD化学物质毒性指南,应用最为广泛,但在我国尚未获得监管机构认可。体内光毒性评价方法可以根据药物是系统给药还是皮肤外用,选择猪、兔、豚鼠、大鼠或小鼠等种属,合理设计给药频率、照射时间点、照射剂量、辐照度、照射时长、光源等。刘丽等在《药物非临床光安全性检测方法》中对应用较多的Morikawa体内光毒性评价方法有较为详细介绍,感兴趣的可自行翻阅。
光过敏性反应是光介导下的以细胞性免疫应答为基础的迟发性过敏反应。药物吸收光能后成激活状态,并以半抗原形式与皮肤中的蛋白结合成为药物-蛋白质结合物(全抗原),经表皮的郎格罕氏细胞传递给免疫活性细胞,引起过敏反应。光过敏性属Ⅳ型迟发型过敏反应,其发生时间相对较长,且有一定的潜伏期。光过敏以豚鼠模型为主,也有采用小鼠耳肿胀、人体血清蛋白结合试验等方法。
光遗传毒性是指在光照条件下,化合物被活化而产生遗传毒性作用。目前主要评价方法包括Photo-Ames试验、Photo-HPRT试验、Photo-MLA试验、Photo-彗星试验等。
光致癌性是指药物直接(光化学致癌作用)或间接增加紫外照射相关的皮肤肿瘤的发生。唯一符合GLP法规的模型是SKH1(hr/hr)裸小鼠模型,但其结果的人体预测性未知。
4、具体技术要求
光毒性评价需要区分药物是系统给药还是皮肤给药。
对于系统给药的药物,可参照3.2部分研究策略推进,首先根据MEC结果判定是否需要开展具体试验。再根据 3R 原则,优先选择一种体外方法,其中3T3 NRU-PT 是目前应用最广泛的试验,通常用于光毒性的初步检测。
在某些情况下(如溶解性差的化合物),可能不适宜采用体外试验初步评估光毒性,此时应考虑进行动物体内或人体试验评估。或根据具体问题具体分析的原则,如果有药物的分布数据,则可支持无需进行进一步光安全性评估的决策。
如果体外光毒性试验结果阳性,则需要开展动物体内光毒性试验,以评估体外试验确定的潜在光毒性与体内试验结果的相关性。或基于具体问题具体分析的原则,如果药物的分布数据提示其体内光毒性风险很低,则无需进行进一步光安全性评估。另外一种选择是,可在临床试验过程中评估光安全性风险,或临床试验期间采取避光措施。一项合适的动物体内或人体光毒性试验阴性结果的参考价值大于阳性结果的体外试验,且该情况下不建议进行进一步的试验,并可预测对人体不存在直接的光毒性。
某些情况下,体内动物试验结果阳性提示的风险程度,可在基于 NOAEL 的风险评估中有所减弱,并通常考虑与Cmax的比较情况,否则需进行临床评估。在所有情况下,如果一项可靠的临床光毒性评估充分提示无相关担忧,则其参考价值大于所有非临床阳性结果的提示价值。
对于皮肤给药的药物,MEC的决策依据与系统给药类似。区别是,组织分布不是皮肤给药光毒性的考虑因素,皮肤给药直接用于皮肤,因此除非用于通常不暴露于光的部位,一般认为药物存在于光暴露组织。另外,除3T3 NRU-PT外,可考虑通过人体皮肤模型评估潜在光毒性风险。
此外,对于 MEC 高于 1000L/mol/cm(290~700nm)的 APIs 或新辅料的皮肤用产品,除光毒性试验外通常需进行光过敏性评估。通常使用拟上市制剂在III期临床试验期间进行。
临床皮肤贴剂的光安全性评价可参照上述临床皮肤制剂的技术要求,对于透皮贴剂,皮肤及全身用药的技术要求均可适用。此外,在整体风险评估时应考虑临床用法(如推荐使用的皮肤部位、用药期限)和贴剂基质的性质(如不透过 UV和可见光)。
5、《ICH基础知识500问》中关于光安全评价的问题汇总
问:为什么需要对药物进行光安全评价?
答:药物的光安全性评价是一个综合过程,可能同时包括对光化学特征、 非临床研究数据以及人体安全信息的评估。药物光安全评价的目的在于确定是否需要采取风险最小化措施以预防人体不良事件的发生。
问:如何进行光安全性评价?
答:光安全性试验评估应结合光毒性、光过敏性、光遗传毒性、光致癌性四种不同的反应进行。目前认为开展光遗传毒性和光致癌性试验对人用药物没有意义,因此指导原则侧重于光毒性和光过敏性。光毒性,又称光刺激性,指的是由光诱导的,组织对光反应化合物的急性反应。光过敏性指的是药物经光化学反应生成光产物导致的免疫反应。
问:为什么要制定S10?
答:S10的制定目的是为支持药物临床试验或上市的光安全性评估推荐国际标准,促进技术要求的协调统一。这份指导原则可以减少各区域之间对光安全性评价技术要求出现实质性差异的可能性。同时也尽量考虑了使用非动物方法或临床数据评估光安全性。
问:S10适用的范围是什么?
答:本指导原则通常适用于新的药物活性成分(APIs)、含新辅料的临床皮肤用制剂(包括皮肤贴剂)和光动力治疗产品。光动力治疗药物是基于光化学反应产生期望的药理作用而开发,通常不需要增加光毒性评价,但需进行毒代动力学及组织分布评估,以期对患者作合适的风险管理。本指导原则一般不适用于多肽、蛋白、抗体偶联或寡聚核苷酸类药物,也不适用于已上市产品成分,除非对APIs或辅料有新的安全性担忧(如剂型由片剂改为外用膏剂)。
问:光安全评价需要考虑的因素有哪些?
答:第一,需要考虑光化学性质。评估潜在光反应性的初步考虑因素是化合物在290~700nm波长范围内能否吸收光子。当化合物在290~700nm波长范围内的摩尔消光系数不高于1000L/mol/cm时,一般认为该化合物不具有足够的光反应性来产生直接的光毒性。
第二,需要考虑组织分布或药代动力学。在一定的光暴露时间内,组织内光反应化合物浓度是确定能否发生光毒性反应的关键药代动力学参数。组织内光反应化合物浓度取决于多种因素,如血浆浓度、组织灌流情况、组织内化合物的结合等。暴露的持续时间取决于由血浆和组织半衰期反映出的清除率。这些参数界定了光反应化合物在组织内的平均滞留时间。
第三,在代谢物方面,一般而言,因为通过代谢通常不会产生与母核明显不同的生色基团,所以无需对代谢物进行单独的光安全性评估。
第四,在药理学特性方面,在很多情况下,药物引起的光毒性源于其化学结构,而不是药理作用。但某些药理作用,如免疫抑制、血红素稳态异常,能增强光诱导反应的敏感性。
问:光安全试验有哪些注意点?
答:在非临床光安全性试验中应该严谨地选择试验条件,如同时考虑模型系统和相关的辐射光谱下的暴露量等。理想的情况是,非临床试验应同时具有较高的灵敏性和特异性。
问:谈到光毒性试验,首先会想到的一个部分是光照条件的选择,光照条件要如何选择?
答:在体外和体内试验中,光照条件的选择都很重要。自然光是人类可能经常接触的有最广泛光谱范围的光源。目前对于日光没有明确的界定,其取决于许多因素,如纬度、海拔、季节、日照时长和天气情况等。此外,人体皮肤对自然光的敏感性取决于许多个体因素,如皮肤类型、解剖部位和肤色晒黑状态等。当前的体外和体内光毒性试验,已成功应用剂量范围为5~20J/cm2的UVA,与夏季正午时分、在温带地区海边长时间户外活动时的光照相当。
(摘编自《ICH基础知识500问》,中国医药科技出版社出版)
问:怎样评估光毒性?
答:评价光毒性的方法包括:化学分析评价光反应性、体外光毒性试验法和体内光毒性试验法。体内方法又分为全身给药和皮肤给药。
如果药物研发者选择化学分析法评价光反应性,应在合适条件下采用药物制剂进行方法学验证以确证其灵敏性,其中一种方法是ROS试验,此方法灵敏度高,可直接预测体内的光毒性物质,但特异性低、假阳性率高。
目前应用最广泛的体外试验是3T3中性红摄取光毒性试验(3T3 NRU-PT),这也是目前认为的可溶性化合物最合适的体外筛选方法。3T3 NRU-PT的灵敏度较高,因此,如果一个化合物试验结果为阴性,则人体光毒性的可能性会很低。但3T3 NRU-PT试验结果阳性不应作为可能具有临床光毒性风险的标志,仅提示需要进一步的评估。
问:关于体内检测和全身给药的光安全试验需要注意什么?
答:已有许多动物种属,包括豚鼠、小鼠和大鼠,用于检测化合物的全身用药光毒性。动物种属的选择应考虑光照敏感性,如发生最小红斑的剂量、耐热性及对照物性能。尽管与有色皮肤相比,无色皮肤用于检测光毒性更敏感,但有色和无色动物模型都可以用。
如果开展体内光毒性研究,最好在设计试验方案前获得化合物的药代动力学信息,有助于选择与预期临床暴露相关的合适研究周期。如果没有化合物的药代动力学数据,应将收集药代信息作为体内光毒性的研究内容。需要注意的是,虽然光毒性是典型的急性反应,但应慎重考虑设计体内试验的研究期限。化合物重复给予后在相关光暴露组织的蓄积可能会增强光毒性反应。同样,化合物每次给予后,重复光照射也会因累积损伤增强光毒性反应。一般而言,采用临床途径给药,选择一天或几天的给药期限较为合理。
问:化合物诱导的光毒性最敏感的早期迹象是什么?
答:在低于引起红斑的正常照射剂量,红斑后水肿是化合物诱导光毒性最敏感的早期症状。光毒性的反应类型因化合物而异,应评估任何确定的光毒性反应的剂量和时间依赖性,如果可能,应确定无毒性反应剂量。
问:对于皮肤给药的光毒性评价有何建议?
答:用于研究全身用药的上述建议同样适用于皮肤用药,包括动物种属选择、研究周期以及光照条件。对于皮肤局部用药,一般应用临床制剂进行试验。应尽可能采用临床拟用条件,在给药后的特定时间对暴露部位进行光照,基于受试制剂的特殊性质确定给药和光照之间的时间间隔。对于皮肤用药,非临床研究常结合急性光毒性进行接触性光过敏性评估。但这些试验方法未经正规验证。因此,一般不推荐这种非临床光过敏性试验。
问:评价一种药物的光毒性的策略是什么?
答:如果受试药物包括辅料的MEC不高于1000L/ mol/cm,不建议进行光安全性试验,而且可以预测不会对人体有直接光毒性,但需要关注经间接机制发生的光毒性(如伪卟啉症或卟啉症)。对于MEC高于1000L/ mol/cm的化合物,研究者需要选择开展一种光反应性试验,若得到阴性结果,可不需进一步评估。根据3R原则,为减少动物的使用,通常在开展动物试验前考虑一种经验证的体外试验方法。在某些情况下(如溶解性差的化合物),可能不适宜采用体外试验初步评估光毒性,此时应考虑进行动物体内或人体试验评估。如果体外光毒性试验结果阳性,则需要开展动物体内光毒性试验,或在临床试验过程中评估光安全性风险,以评估体外试验确定的潜在光毒性与体内试验结果的相关性。
(摘编自《ICH基础知识500问》,中国医药科技出版社出版)
参考文献
[1] 邱云良, 李华, 汤纳平等. 喹诺酮类抗生素体内光毒性比较研究[C]// 首届中国药物毒理学年会(2011年)暨国际药物非临床安全性评价研究论坛论文集. 2011.
[2] 丁世敏. 磺胺类抗生素的光降解及其光致毒性研究[D]. 西南大学, 2019.
[3] 药物的光安全性评估ICH-S10。
[4] 药物刺激性、过敏性和溶血性研究技术指导原则(2014)(NMPA) 。

来源:王俊巍,药理毒理开发


