骨膜是覆盖在骨表面的一层柔性组织膜,由外层纤维层和内层胚芽层组成,外层纤维层(尤其是在骨干上)具有定向排列的胶原纤维。人们普遍认为,骨膜在生理性骨形成和病理性缺损愈合过程中都是不可或缺的,切除骨膜会严重影响骨形成。尽管骨膜具有这些重要功能,但在许多临床病例中,如严重的开放性骨折或骨肿瘤切除术,骨膜的损伤往往不可避免,导致骨膜和骨修复困难,这成为目前临床上的一大难题。为了解决这一问题,包括手术疗法在内的传统骨膜修复方法需要自体或异体移植物来恢复天然结构和功能;然而,这些方法由于存在可用性有限、供体部位发病率高和免疫排斥等并发症而受到很大限制。因此,具有理想特性(包括适合细胞粘附和增殖、可模拟胶原纤维的定向表面纳米形貌以及易于粘附到骨表面)的工程生物材料在骨膜修复方面大有可为。基于组织工程学的优势,近年来已开发出许多工程骨膜材料,并取得了良好的效果。遗憾的是,大多数研究忽略了天然骨膜中定向排列的胶原纤维,而定向表面纳米形貌的获得过去需要使用特定的设备,如定向电纺丝仪或光刻机,这增加了额外的成本和时间消耗。此外,虽然有一些工程骨膜材料具有生物粘附性,但这些材料仍很有限,因为缺乏一个完整的修复策略来满足高效骨膜修复所需的上述三个方面的要求。因此,新型人工骨膜材料仍急需开发。
受自然界骨膜的定向胶原结构启发,来自南京大学医学院的Junyi Che和蒋青团队提出了一种复合人工骨膜,其表面有一层含有碳纳米管(CNT)的定向纳米层,两端交联有粘性聚多巴胺(PDA)水凝胶。只需在水浴中拉伸薄膜,就能快速方便地获得可模拟骨膜胶原纤维定向排列的定向表面结构。在碳纳米管的帮助下,本研究的人工骨膜表现出足够的机械强度和理想的定向纳米拓扑结构表面,这进一步诱导了人骨髓间充质干细胞(hBMSCs)在膜上的定向排列。这些定向的人骨髓间充质干细胞能表达更高水平的成骨基因和蛋白,而由此产生的复合骨膜可通过 PDA 水凝胶在大鼠大规模腓骨缺损模型中稳定固定,最终显示出良好的骨再生能力。本研究预计,所开发的功能性人工骨膜在治疗骨与骨膜复合缺损的生物医学应用方面具有巨大潜力。相关工作以题为“Artificial Periosteum with Oriented Surface Nanotopography and High Tissue Adherent Property”的文章发表在2023年9月25日的国际著名期刊《ACS Applied Materials & Interfaces》。
1. 创新型研究内容
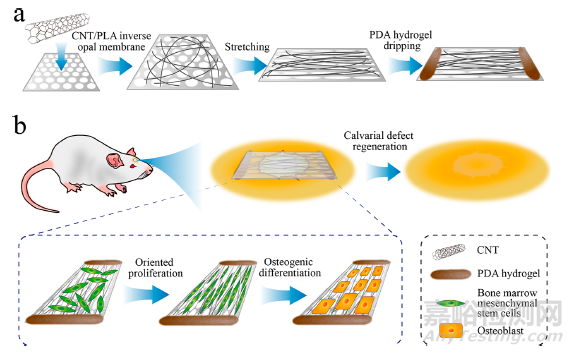
受生物材料满足骨膜修复过程前提条件的理想特性的启发,本研究提出了一种具有定向表面纳米形貌和强骨粘附性的人工骨膜,如图 1 所示。利用反蛋白石拉伸聚乳酸(PLA)膜后生成定向椭圆结构。此外,碳纳米管(CNTs)是一种常用的生物材料,可作为细胞外基质纤维蛋白的生物仿真模拟物,本研究将其涂覆在膜的表面。CNTs的高拉伸柔韧性保证了聚合物反乳白膜在拉伸过程中复合膜的完整性,方便快捷地获得了预期的胶原纤维样定向排列结构,这进一步诱导了细胞在膜上播种后的排列。这样,通过普通的实验设备就能快速方便地制备出模拟骨膜胶原纤维的取向表面纳米形貌。为了进一步获得生物粘附性,本研究在膜的两端制作了受贻贝启发的聚多巴胺(PDA)水凝胶,以帮助膜片粘附在病变组织表面。因此,本研究整合了这些功能材料,开发出了一种新型人工骨膜,满足了整个骨修复过程的所有要求。
图1 人工骨膜制备示意图
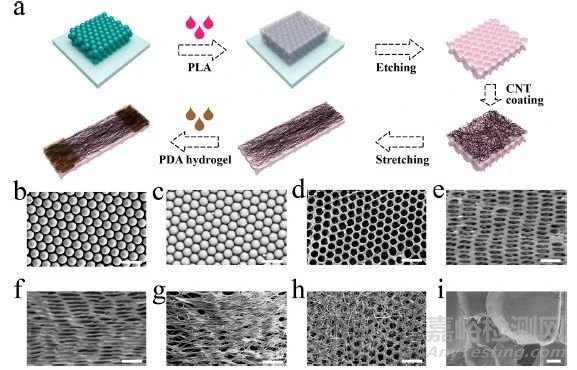
为了制备具有一层定向纳米层表面的人工骨膜(图 2a),本研究首先制备了单分散的二氧化硅纳米粒子,然后在毛细力和对流作用下自组装成有序的阵列结构,为反蛋白膜提供了可靠的模板(图 2b)。然后将溶于三氯甲烷的聚乳酸滴在二氧化硅纳米粒子模板表面,自然干燥后形成固体支架(图 2c)。然后,用氢氟酸去除纳米二氧化硅模板,得到具有反蛋白石结构的多孔聚乳酸膜。在扫描电子显微镜(SEM)下,如图 2d 所示,可以清晰地观察到一层周期性多孔结构。为了制备取向表面纳米层状结构,在水浴条件下拉伸聚乳酸反乳白膜,得到不同拉伸时间的膜。拉伸比例越大,膜上的孔隙就越细长(图 2e,f)。据报道,碳纳米管具有优异的导电性和较高的机械性能;此外,碳纳米管的杆状形状和纳米级尺寸使其能够作为细胞外基质纤维蛋白的生物仿生模拟物。因此,本研究在聚乳酸反乳白膜表面引入了 CNTs,以增强骨膜材料的性能。将 CNTs 溶液均匀滴在膜表面并干燥,即可在膜上涂覆 CNTs。最常用的 CNT 定向排列方法是电弧放电和化学气相沉积。然而,这两种方法都需要使用专门的仪器。本研究发现了一种无需特殊设备就能方便快捷地构建定向表面纳米层的方法。在水浴条件下对膜进行简单拉伸后,与未拉伸的膜相比(图 2g),CNTs 实现了定向排列(图 2h)。最后,将 PDA 水凝胶交联到聚乳酸膜的两端,使复合膜具有粘附性能,如图 2i 所示,在原位形成了交联的 PDA 网络。
图2 人工骨膜的结构和表征
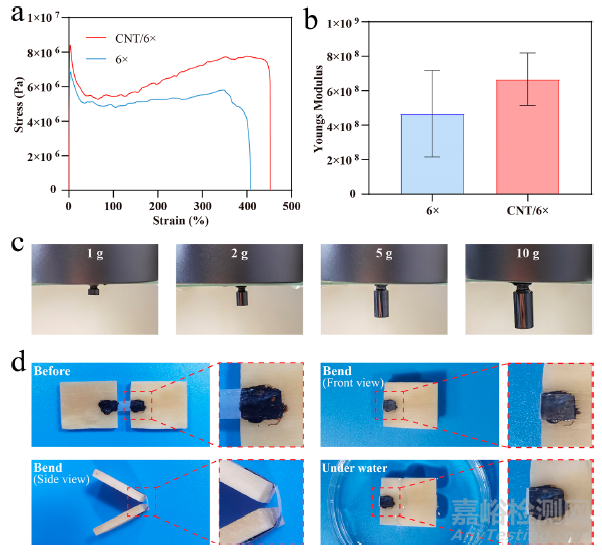
为了探索添加碳纳米管是否能改善聚乳酸反乳白膜的机械性能,本研究测试了其机械性能。结果表明,涂覆了 CNT 的聚乳酸膜(CNT/6× 组)的杨氏模量高于未涂覆 CNT 的相同拉伸比的聚乳酸膜(6× 组)(图 3a,b),这表明 CNT 在改善涂覆膜的力学性能方面具有优势。随后,本研究在鱼明胶中加入多巴胺,并用高碘酸钠交联,在 CNT 涂层聚乳酸膜的两端制备了 PDA 水凝胶(图 S2 和 S3)。流变特性曲线显示,PDA 水凝胶具有剪切稀化行为,这表明其在测量的剪切速率范围内具有稳定的流变特性。此外,PDA 水凝胶的储存模量(G′)明显大于损失模量(G″),表明 PDA 水凝胶具有高结构性。为了确定 PDA 水凝胶的粘附能力,本研究将人工骨膜固定在支架底部,并将不同重量的人工骨膜粘附在 PDA 水凝胶上。如图 3c 所示,人工骨膜可承受高达 10 g 的重量。同时, PDA 水凝胶与牛骨的搭接剪切应力高达 0.48 N/cm2。由于 PDA 水凝胶具有很强的粘附性,复合膜在体外应用时能够牢固地附着在骨组织表面。此外,复合膜还能保持完整,紧贴组织,甚至能经历弯曲和水浸泡(图 3d)。这些特性使人工骨膜成为一种坚固的组织补片,适合动态和复杂的生理环境。
图3 人工骨膜的机械性能
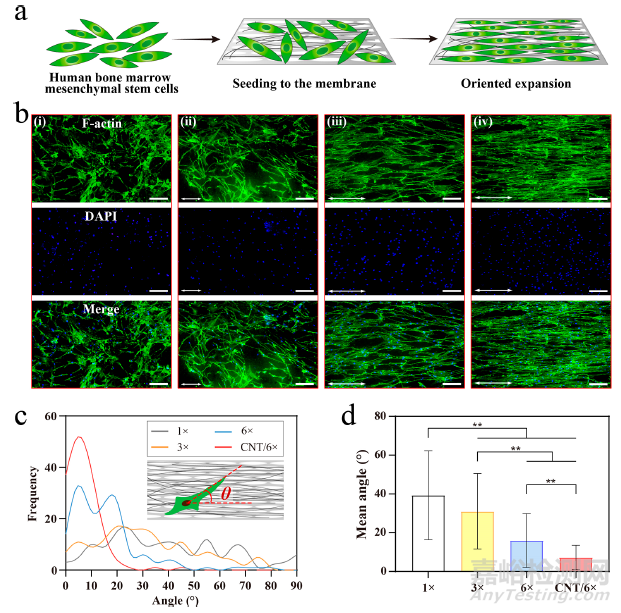
研究表明,自然界骨骺中几乎所有的纤维都是纵向取向的,同样,片状骨中也存在高度取向和相互连接的骨细胞网络。因此,本研究成功制备了可模仿天然骨膜中胶原纤维排列的定向纳米表面,并进一步分析了定向纳米表面对 hBMSCs 生长的影响(图 4a)。5 天后,将 hBMSCs 固定并用类磷青霉素/DAPI 培养,以显示其细胞骨架和细胞核。结果(图 4b)显示,hBMSC 微丝在未拉伸的反蛋白膜上(1×组)呈不规则排列。相反,拉伸膜上的 hBMSC 沿拉伸的纵向广泛分布。可以清楚地看出,随着拉伸率的增加,细胞形态变得更加细长。特别是涂有 CNT 的 6× 拉伸膜上的细胞排列略好于未涂 CNT 的 6× 拉伸膜,这表明排列整齐的 CNT 可进一步增强细胞排列的定向性。对频率分布和平均取向角的定量分析显示,随着拉伸比的增加,hBMSCs 低取向角的频率分布变高(图 4c),平均取向角明显变小(图 4d)。此外,CNT/6×组的低取向角频率分布最高(<20°),平均取向角最小,这表明本研究的功能复合膜能有效诱导细胞定向生长。
图4 人工骨膜上细胞的分布和方向
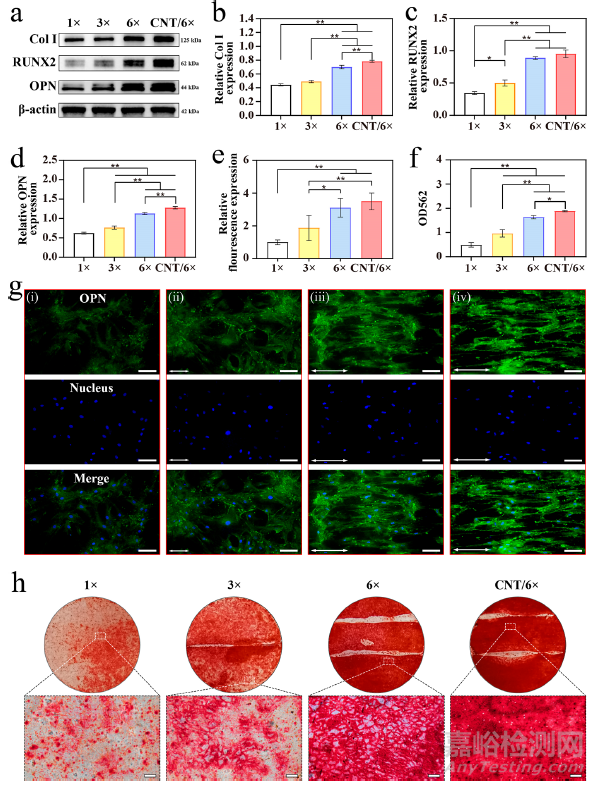
众所周知,表面形态和材料硬度会强烈影响多种细胞的行为。此外,一些研究表明,排列整齐的纳米纤维结合机械刺激可引导间充质干细胞分化成成骨细胞。因此,本研究进一步测试了 CNT/6× 膜能否促进 hBMSCs 的成骨分化。第 10 天的 Western blot 结果(图 5a-d)显示,6×拉伸组 Col I、RUNX2 和 OPN 的表达明显高于 3× 拉伸组,均优于未拉伸组。此外,在两种 6× 拉伸膜中,膜表面涂有 CNT 的组(CNT/6× 组)成骨细胞相关蛋白的表达量稍高。这可能是由于高拉伸比和 CNTs 涂层使膜表面具有更好的定向结构,诱导了细胞排列,从而促进了 hBMSCs 的成骨分化。同时,CNTs 还增强了膜表面的机械强度,在一定程度上进一步促进了 hBMSCs 的分化。免疫荧光染色验证了 OPN 的表达。如图 5g 所示,在 6× 组和 CNT/6× 组的细胞中可以观察到代表 OPN 的绿色荧光信号强度明显较高,而在拉伸比较低的组中荧光强度要低得多。定量分析显示,CNT/6×膜的荧光强度约为 1× 膜的 4 倍(图 5e)。骨组织由平行排列的 Col I 纤维组成,其上沉积有片状碳酸盐磷灰石晶体。因此,为了说明诱导成骨分化的能力,本研究在21 天后用茜素红染色法评估了矿化效果(图 5f,h)。与未拉伸组或低拉伸比组相比,拉伸 6 倍的膜表面可观察到更多的钙结节。此外,已有研究证实 CNT 可增强 hMBSCs 的成骨分化。同样,在本研究中,与 6× 组相比,CNT/6× 组表现出更密集的钙结节。这些结果表明,反乳白聚乳酸膜与高伸长后的 CNT 涂层相结合,最有可能促进骨分化。
图5 人骨髓间充质干细胞体外成骨分化
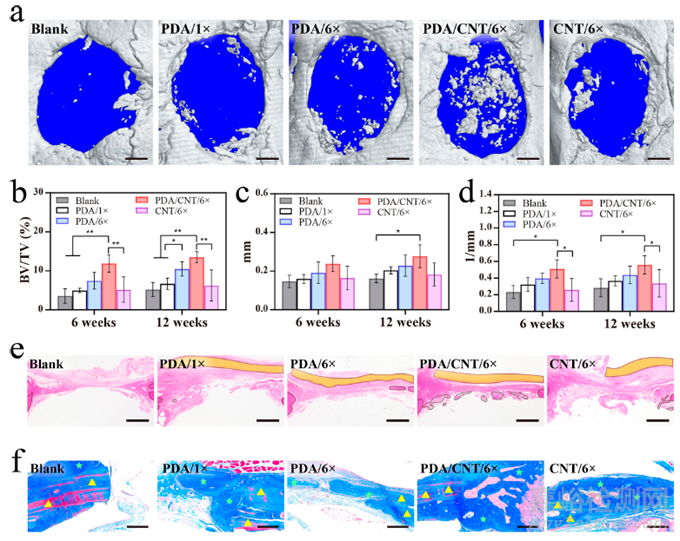
与之前的研究一样,为了测试本研究的人工骨膜在体内促进骨再生的能力,本研究通过手术在大鼠体内创建了伴有大面积骨膜损伤的钙骨缺损模型。腓骨缺损模型中的骨再生是由发生在骨内膜或骨膜下的膜内骨化诱导的。而且,腓骨缺损模型是一种非承重模型,可以消除机械应力对缺损部位再生的影响。因此,本研究选择腓骨缺损模型来测试工程骨膜材料的特性。为了减少对实验动物的伤害,根据体外实验的结果,实验组只选择了含有或不含 CNTs 的 6 倍拉伸聚乳酸逆乳白膜和 PDA 水凝胶。大鼠模型建立后,将不同的骨膜植入并覆盖在骨缺损部位。通过三维重建显微 CT 分析(图 6a),可以发现 PDA/CNT/6× 组在第 12 周时新形成骨的面积最大。用 PDA 层处理未拉伸膜(PDA/1× 组)后,几乎观察不到新骨形成,这与空白对照组的结果相似。CNT/6× 处理也未能有效再生缺损的腓骨,这可能是因为没有 PDA 水凝胶的膜没有粘附在缺损部位,从而导致膜移位而失去功效。对新生骨组织的定量测量进一步证实,如图 6b-d 所示,PDA/CNT/6× 组在骨量/组织体积(BV/TV)、骨小梁厚度(Tb.Th)和骨小梁数目(Tb.N)方面的促进作用最好。血红素和伊红(H&E)染色显示 PDA/CNT/6× 组有大量新再生骨组织(图 6e)。在 CNT/6× 组中,本研究甚至可以发现膜移位的痕迹,而在复合膜覆盖的一侧则观察到更多新骨形成。此外,通过 MASSON 染色法还可区分和确定原发性骨组织和不规则新骨组织等片状骨。同样,与其他处理组相比,PDA/CNT/6× 处理组产生的新骨量最多(图 6f)。通过 H&E 染色和酶联免疫吸附试验进行的生物安全性检测显示,各组的器官(心、脾、肝、肺和肾)无明显差异(图 6f),血清肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)无统计学差异,表明 PDA/CNT/6× 对大鼠主要器官无明显毒性。这些结果证实了 PDA 水凝胶以及 CNTs 涂层和定向表面纳米形貌在膜固定、模拟天然骨膜的结构和功能以及促进骨再生方面的重要作用。
图6 不同膜促进大鼠颅骨缺损再生的评价
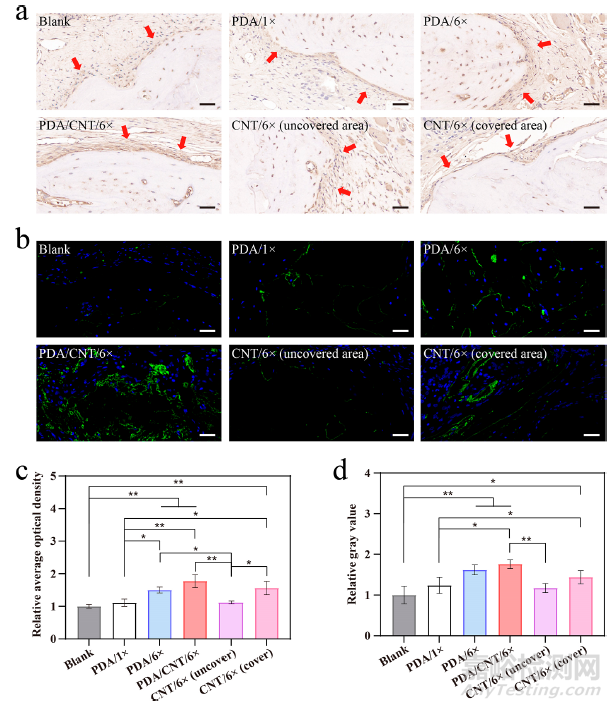
此外,本研究还检测了第 12 周时新形成骨中成骨相关蛋白的表达。首先,用免疫组化染色法检测新形成骨的骨膜中成骨细胞分泌氧化氮(OCN)的情况。如图 7a 所示,空白组中观察到的 OCN 阳性成骨细胞最少,骨膜颜色最浅,而 PDA/1× 组中 OCN 的表达水平明显上升。此外,在拉伸膜后,PDA/6× 组和 PDA/CNT/6× 组的 OCN 表达水平显著增加,而 PDA/CNT/6× 组的骨膜中 OCN 表达水平最高,这是由于胶原样 CNT 纤维和定向表面纳米层的共同作用。有趣的是,CNT/6× 膜缺乏有效的固定作用,因此未覆盖区域的 OCN 表达与空白组相当,导致骨再生效果不佳。定量结果显示,PDA/CNT/6×组的 OCN 表达量几乎是空白组的两倍(图 7c)。随后,本研究还进行了 OPN 免疫荧光染色,其结果与 OCN 免疫组化的趋势一致(图 7b,d)。通过这些结果可以发现,PDA/CNT/6×膜通过有效的膜固定和定向表面纳米层析,能有效促进骨再生过程中 OCN 和 OPN 的形成。
图7 OCN和OPN在新生骨组织中的表达
2. 总结与展望
本研究提出了一种新型人工骨膜,它可以附着在缺损区域并诱导骨再生。本研究使用具有良好生物相容性的聚乳酸(PLA)构建了一种具有反蛋白石结构的膜。在表面涂覆 CNTs 后,拉伸该膜以获得具有一定机械强度的定向纳米颗粒状表面,从而诱导细胞定向排列。植入膜表面的 HBMSCs 能沿着纳米拓扑结构的方向生长,与随机排列组相比,其成骨细胞相关蛋白的表达更好。膜的两端都滴上了受贻贝启发的 PDA 水凝胶,使膜具有高组织粘附性。最后,本研究的新型骨膜在促进体内骨缺损修复方面表现出了卓越的能力。这项研究为再生医学应用开发了一种新型人工骨膜,可为临床修复骨膜缺损提供一种新策略。
文章来源:https://pubs.acs.org/doi/10.1021/acsami.3c07561