从医疗器械开发的角度来看,人因工程、可用性和用户体验活动的目标是一致的:以安全、有效、直接、愉快的方式发布满足用户需求的产品。
但这些术语的技术定义可能有所不同。因此,这些术语通常被认为是明显不同的,这对医疗器械开发人员是不利的。
最好的情况是这种误解导致混淆。最坏的情况可能是:它不符合用户的标准和口味,因为制造商太专注于技术和FDA的障碍,或它不符合FDA的指南,因为制造商太关注用户体验和美学设计。
为了避免这两种情况,不要再纠结于术语。相反,采用一个强大的开发过程,旨在提供卓越的用户体验作为制造商的首要目标,同时满足FDA的指导方针和IEC标准。
一.术语定义:人因工程、可用性和用户体验
1.人因工程:
2016年FDA人因指南将人因工程(通常简称为HFE-Human Factors Engineering)定义为:
将有关人类行为、能力、限制和医疗器械用户的其他特征的知识应用于医疗器械的设计,包括机械和软件驱动的用户界面、系统、任务、用户文档和用户培训,以增强和证明安全有效的使用。
简单地说,HFE关注的是最终用户(人)如何安全有效地访问产品的功能(因素)。
还要注意的是,FDA承认IEC 62366-1是现行的国际标准,应该指导医疗器械研发团队的HFE工作。
2.可用性和可用性工程
可用性(又名可用性工程或UE-Usability Engineering)与HFE完全相同。HFE只是美国使用的术语,而欧洲和大多数其他国家将其称为UE。甚至FDA也承认,“人因工程和可用性工程可以被认为是同义词。”
3.用户体验
用户体验(UX-User experience)是指最终用户对产品的体验。用户体验是一个更广泛的、包罗万象的术语,广泛应用于医疗器械行业之外。用户体验包括终端用户与公司、服务和产品交互的所有方面。
为了制造商的目的,根据通用的ISO定义之一,用户体验包括所有用户在使用之前,使用期间和使用之后发生的情感,信念,偏好,感知,生理和心理反应,行为和成就。此外,用户体验由产品的许多不同方面组成,包括可用性和安全性,以及价值和可取性。
高质量的用户体验考虑了其他因素,如可取性、品牌感知以及对企业和用户的总价值。它还可以扩展到整个产品或服务生态系统。
从某种意义上说,可用性属于更广泛的用户体验范畴,因为用户至少需要足够的可用性来完成任务。
二. 理解可用性文件
FDA要求的可用性工程文件包含医疗产品开发项目的所有用例、用户需求和用户测试数据。实际上它并不是一个“文件”,从而导致误解。可用性工程文件是一个指向项目所需的所有可用性信息和过程证据的目录。
目前大多数医疗器械公司,尤其是初创公司,没有专门的内部人为因素团队。这一责任通常由负责FDA合规负责人人承担。一旦这种情况发生,制造商的设计团队在早期开发中就很少会参考它。
三. 有效回顾可用性工程文件各部分的技巧
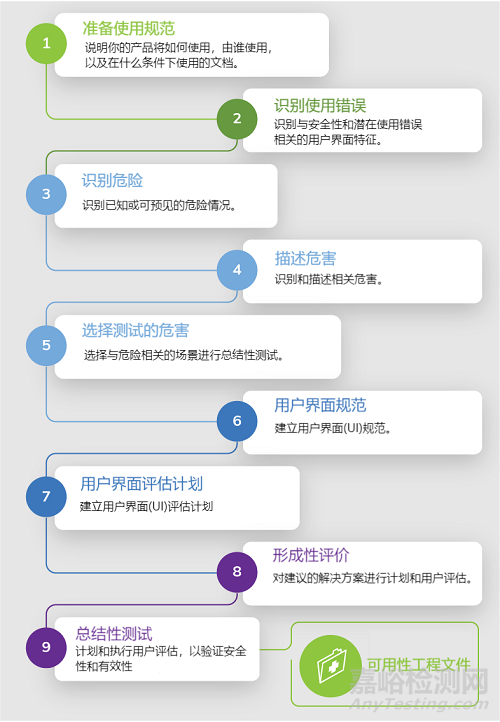
考虑审查标准IEC 62366-1第5节,可用性工程在医疗器械中的应用。它解释了可用性工程文件的九个部分。
以下是针对每种情况的一些建议:
1. 准备使用规范
使用规范文件是医疗器械FDA提交包的必要部分。本文档说明了您的产品将如何使用,由谁使用,在什么条件下使用。在准备过程中,制造商将详细说明产品的预期使用环境、患者人群、医疗指征等。
使用规范文档为制造商最终开发的产品定下了基调。为了使产品满足用户的需求,制造商必须构建一个深思熟虑和全面的使用规范文档。
2. 识别与安全性和潜在使用错误相关的用户界面特征
制造商正在设计一种医疗器械,供特定的人以特定的方式使用。这是制造商的义务,以确保它可以安全地通过识别潜在的使用错误之前发生。对使用场景进行任务分析是充实它们的好方法。
3.识别已知或可预见的危险和危险情况
一旦识别出潜在的使用错误,需要描述它们可能产生的影响以及它们可能如何伤害他人。团队协作共同思考如何有人可能滥用或伤害您的器械,实际上可以带来新的突破,帮助使您的器械更安全。
4. 识别和描述与危险相关的场景
将预期的使用场景与识别的潜在错误相结合将导致潜在的与危险相关的场景。了解可能出现的错误将帮助制造商的设计团队围绕这些危险进行设计。
5. 选择担任总结性测试的场景
制造商可以在终结性测试期间测试所有或仅部分与风险相关的场景。这取决于制造商愿意承担多大的风险。
一个常见的错误是,在设计过程中选择场景的时间过晚,以至于无法对开发团队有用。这是一个很容易犯的错误,因为总结性测试直到开发完成了90%才会发生。
我们建议在项目的第一天就确定与危险相关的场景。确保它们是显而易见的,这样制造商的设计团队就可以尽早消除它们。
6. 建立用户界面规范
用户界面规范包含所有用户界面需求以及人们与器械交互的所有方式。它建立在刚才讨论的前三个部分的基础上。一个技巧是使需求尽可能具体和可测量,因为它们需要被测试。
7. 建立用户界面评估计划
形成性和总结性的用户界面评估应该在第一天就包含在制造商的主项目时间表中。在我们的经验中,它们通常是缺失的,或者没有分配足够的时间和资源。
尽早了解项目过程中需要评估的内容将有助于设计团队更好地规划任务。
例如,许多接口评估需要技术团队提供某种类型的原型。制作一个或多个原型所需的时间和资源需要提前做好计划。
8. 形成性评价
用户对团队的假设、概念和原型的评估应该尽早且经常地进行。它们可以促进设计团队和用户之间的密切合作。如果执行得当,它们将为开发团队提供提供出色用户体验所需的反馈。
9. 总结性测试
还记得5中确定的与危险相关的场景吗?总结性测试的目的是确保一个人可以在这些特定的情况下安全地操作你的器械。FDA希望你们在非常特殊的条件下测试大约15个主要用户。请记住,如果医生和护士都被认为是主要用户,您需要对30人(15名医生+ 15名护士)进行测试。