前 言
冷冻干燥是延长药品保质期的重要工艺手段;
到2015年,冻干注射剂产品占所有新的注射剂药品的近一半;
本篇文章将FDA从2015年 - 2019年收到的263个冻干注射剂产品(创新药和仿制药)中确定的制造相关缺陷进行分类;
本文在此仅讨论OPMA收到的监管报告中确定的与制造商相关常见缺陷;
仅为申请人每个单元操作中常见缺陷;
并非对申请人需要进行的潜在研究进行全面讨论;
为避免FDA发布大量缺陷,申请人应明确提供产品开发过程的详细信息,以及如何利用开发数据和风险评估来减轻与商业制造过程相关的任何风险;
数据来源和研究方法:
从2015年到2019年,共收到263份冻干注射产品的规范提交文件,并在FDA的内部数据库中搜索与制造相关的缺陷;
本研究调查了原始申请和修正案;
根据生产冻干注射产品所需的常用操作流程,OPMA发布的缺陷分为四类:
混合、过滤、填充和冷冻干燥;
每一类别缺陷以占与制造相关缺陷总数的百分比表示;
文中还提供了FDA发布的每个类别的缺陷示例(文中灰色底色部分);
需要注意的是,在过滤和下游过程中观察到的与无菌保证相关的缺陷超出了本工作的范围。
FDA从2015年 - 2019年收到的263个冻干注射剂产品(创新药和仿制药)
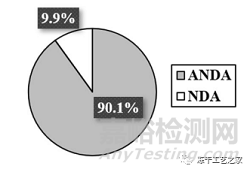
图一:冻干注射剂提交文件中的制造相关缺陷
(在263份提交文件中约占83%,包括199个ANDA和19个NDA)
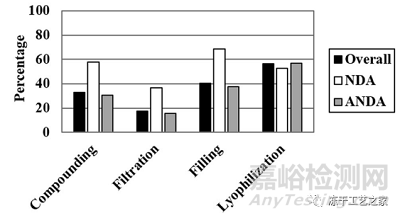
图二:在多个操作单元观察到多个缺陷
(缺陷占比之和,超过100%)
冻 干
导致冻干注射剂审批延迟的主要原因之一是不良的冻干工艺开发过程;
冻干工艺开发应包含对处方的全面表征;
获得处方所对应的关键温度:晶体处方的共晶点温度Teu、无定形处方的最大浓缩溶液玻璃态转变温度Tg’、塌陷温度Tc;
冻干工艺根据以上关键温度进行设计;
差热扫描量热仪(DSC)确定处方的玻璃态转变温度Tg’,在对处方进行热分析时需确定是否在预冻阶段加入退火以降低由于溶质或水不完全结晶带来的西林瓶破裂风险;
未能提供充分的必要数据来全面表征特定处方对应的冻干工艺设计过程将导致缺陷的发布;
在对申请人提交的热分析数据重新审查的过程中,发现申请人对于DSC图谱的错误解读(例如将冰融化解释为玻璃态转变温度);
在确定了处方的关键温度后,申请人应根据关键温度确定预冻和一次干燥阶段使用的关键工艺参数;
虽然预冻以及预冻阶段的成核过程可能对后续的干燥过程产生重大影响,但冻干注射剂的申报中,与预冻步骤相关的缺陷非常少出现;
非常要引起重视的是:申请人必须了解在用于注册批或商业生产的冻干机上,是否能够实现类似的预冻速率(设备性能限制);
最常见的冻干相关缺陷之一是:缺乏对一次干燥、二次干燥终点确定的合理解释;
提前结束一次干燥进入二次干燥可能造成产品的塌陷或者回融,申请人应对一次干燥终点的确定给出充分的解释和数据支持;
申请人很少在商业批放大中,监测产品温度和其他冻干过程参数;
商业批过程中没有足够的控制策略的一个可能原因是适用于商业冻干机的过程控制技术非常有限(热电偶温度探头、皮拉尼压力计、压力升测试等);
然而,有多种方法可以用于确定产品温度和干燥终点(见文末文献汇总);
二次干燥阶段,需要注意由于升温太快导致的产品塌陷;
不充分的二次干燥会导致产品水分过高从而引起产品在质保期内不稳定;
申请人应对二次干燥阶段关键工艺参数有充分研究和认识;
药品的玻璃态转变温度Tg随着药品水分升高而降低;
应对药品目标含水量的确定做充分数据支持,以确保成品的玻璃态转变温度高于长期和加速条件下的存储温度;
在商业批放大过程中需要制订科学的取样计划,以降低大型冻干机板层不同位置样品差异带来的产品风险;
取样样品需进行:外观、水分、复溶时间这些和塌陷相关性很高的参数测试;
当商业生产没有计划继续扩大规模时,应提供注册批次的批次均匀性研究结果;
需要注意,实验室冻干机开发的冻干工艺不一定适用于商业规模冻干机;
在完全了解设备工作能力的情况下,申请人应再次确认所有与批量相关的关键工艺参数(如:板层温度、升降温速率、保持时间、腔体压力);
并提供基于数据和科学方法的放大策略,以确保产品在实验室规模和生产规模之间有相同的热历史;
从实验室规模到生产规模放大时,不应忽视传热特性(如西林瓶传热系数、腔体局部压力变化以及预冻速率差异的影响);
申请人应了解冻干机装载量(部分装载/满载)不同带来对产品的影响;例如:冻干机装量变化是放大过程中的一个重要过程变量,在商业生产中应降低与潜在过载相关的风险;
与冻干相关的常见缺陷示例:
我们注意到申报批的冻干工艺参数会直接应用到商业批,未考虑此转移的批量变化;
申报批应用的冻干工艺关键参数(如:板层温度、升降温速率、腔体压力)在批量变化后,仍然可以生产出符合质量指标的产品。需要提供充分科学的依据;
商业放大使用的冻干机,需要提供每个托盘内装载西林瓶数量、每个板层上托盘数量、以及冻干机使用的总板层数量信息;
证明放大批量后,是否使用合理的方式重新确定一次干燥终点;
冻干机的装载量限制(工作能力限制)是冻干工艺开发和放大过程中的重要变量,根据目前使用冻干机的工作能力以及当前装量说明如何在商业生产批次中降低与冻干机过载(chocked flow、冷阱过载等)相关的风险;
提供用于预期商业批次的详细取样计划,以充分获取每个板层上不同位置西林瓶在药品关键质量属性方面的变化或一致性数据。此外,通过相应的抽样计划来修订主批次记录;
请提供为药品进行冻干工艺开发的相关过程数据。冻干的关键工艺参数,如:板层温度、腔体压力是如何确定的。解决以下与所提交冻干工艺参数确定的相关问题:
解释一次干燥阶段的板层温度是如何去顶的,其跟玻璃态转变温度(Tg’)、塌陷温度(Tc)之间的关系。同时提供热分析数据来支持此参数确定的合理性;
提供申报批的冻干工艺曲线图,包含板层温度及腔体压力数据;同时提供压力升数据,以解释一次干燥、二次干燥终点确定的合理性;
分别提供申报批工艺研究阶段和商业批的详细批量信息:每个托盘上西林瓶数量、每个板层的托盘数量、使用的板层数量;
为商业批次提供详细的取样计划,以充分获取每个板层上不同位置的西林瓶在药品关键质量属性方面的变化或一致性;
退火步骤可以促进甘露醇结晶(消除甘露醇重结晶),从而最大限度降低西林瓶破裂的风险;我们注意到你提供的冻干工艺不包含退火步骤,请说明采取了那些控制措施(如果有的话),以降低冻干和存储过程中西林瓶破裂的风险;
最后的话:
配液、过滤、灌装、冻干四个工艺阶段中,与冻干相关的缺陷数量是最多的;
以上缺陷,看起来各自独立,但背后都是要求申请人对冻干工艺的原理、设备和过程有深刻的认识。