摘 要
目的:通过分析全国药物临床试验机构备案和试验承接现状,探索新备案机构的发展策略和方向。方法:以2021 年12 月31 日前进行药物临床试验备案的医疗机构为研究对象,汇总其2020 年1 月1 日至2021 年12 月31 日期间登记的药物临床试验,从多个维度分析备案机构数量变化趋势及临床试验开展现状。结果:自备案制度实施至2021 年底,共有270 家新备案机构完成备案,占总备案机构数量的23.6%。然而,仅有不到10% 的临床试验选择在新备案机构开展,且新备案机构的备案专业与临床试验需求存在供需失衡的情况。结论:药物临床试验机构备案管理的实施有效地促进了医疗和临床试验资源的释放,但新备案机构整体利用度仍有较大提升空间。新备案机构可从提升自身能力、调整专业发展策略等方向提高新备案机构的认知度、利用度,推动我国临床研究产业持续发展。
Objectives: By analyzing the registration status and the implementation of clinical trials in drug clinical trial institutions, this paper aims to explore the development strategy and direction of newly registered institutions. Methods: Taking drug clinical trial institutions registered before 31 December 2021 as the study subjects, this paper analyzed their drug clinical trials registered from January 1, 2020 to December 31, 2021. The trend of the number of registered institutions and the status of clinical trials were analyzed from various aspects. Results: Since the implementation of the clinical trial institution registration system, there are a total of 270 newly registered institutions, accounting for 23.6% of the total number of institutions. However, only less than 10% of clinical trials were conducted at newly registered institutions, and there was an imbalance between the new institution supply and clinical trial demand. Conclusion: The implementation of registration system has effectively promoted the release of medical and clinical trial resources, but the overall utilization rate of newly registered institutions still has much room for improvement. New institutions can increase their recognition and utilization by enhancing their own capabilities and adjusting specialty development strategies to promote the sustainable development of clinical research industry in China.
近年来我国医药产业蓬勃发展, 药物临床试验数量不断增加。与2020 年相比,2021 年我国药物临床试验登记总量增加29.1%,其中新药临床试验登记量增加38.0%[1]。药物临床试验量的快速增长对临床试验机构的数量和质量都提出了更高的需求。而我国自2017 年10 月发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[2],提出药物临床试验机构实行备案管理,至2019 年12 月《药物临床试验机构管理规定》[3] 正式开始施行备案制度,一系列政策均鼓励药物临床试验机构深度发展,充分发挥各机构资源优势。
随着药物临床试验机构数量的增加,备案机构的分布以及试验承接情况持续受到关注。房虹等[4] 就全国药物临床试验机构备案情况进行分析,提出药物临床试验机构备案制度的落地有助于改善临床试验资源不均衡的现象,促进我国医药研发产业趋向供需平衡的态势。在政策鼓励和行业发展的大背景下,新备案机构群体正在逐渐壮大,因此亟需针对新备案机构释放临床试验资源的效果进行深入探讨。本文对2020年1 月1 日至2021 年12 月31日期间全国药物临床试验机构展开统计,从备案情况和药物临床试验承接两个方面的多个维度进行对比分析,聚焦新备案机构的药物临床试验开展情况,探讨不同专业的临床试验供需环境,为新备案机构的发展提供参考,以促进产业健康发展。
1、 对象与方法
1.1 研究对象
以2021 年12 月31 日前在药物临床试验机构备案管理信息平台[5] 备案的药物临床试验机构为研究对象,其中新备案机构定义为在备案前未取得国家药品监管部门会同国家卫生健康主管部门资格认定的药物临床试验机构,原有机构定义为此前取得过国家药品监管部门会同国家卫生健康主管部门资格认定且已进行备案的药物临床试验机构。同时,本研究汇总了2020年1 月1 日至2021 年12 月31日期间在药物临床试验登记与信息公示平台[6] 上登记的药物临床试验,重点分析新备案机构开展药物临床试验的情况。
1.2 研究方法
1.2.1 临床试验机构利用度
临床试验机构利用度借鉴了资源利用率(Utilization Rate)的概念[7],计算公式为:临床试验机构利用度(%) = 该专业所有机构参与临床试验的总时长(年)/该专业所有机构具备临床试验资质或备案的总时长(年)x100%。
利用度为100% 意味着平均每家机构任一时间有且仅有一个正在进行的临床试验项目,利用度大于100% 代表平均每家机构特定专业有多项临床试验同时开展,而小于100% 则说明临床试验项目间存在空档。
1.2.2 临床试验集中度
临床试验集中度借鉴市场集中度(Market Concentration Ratio)的概念[8],反映某专业试验量排名前10% 的机构所承接试验总量的比重。计算公式为:临床试验集中度(%) = 该专业临床试验量排名前10% 的机构试验数量之和/ 该专业临床试验总数x100%。
临床试验集中度数值越高,代表该专业的临床试验越集中于头部机构,形成寡占市场。
1.2.3 统计方法
采用Microsoft Excel 和IBM SPSS Statistics 23 对数据进行统计和分析。数据之间的相关性使用皮尔逊相关系数(Pearson's r)表示,P<0.05 为有统计学差异。
2、 结果
2.1 药物临床试验机构备案情况
2.1.1 备案机构数量变化趋势
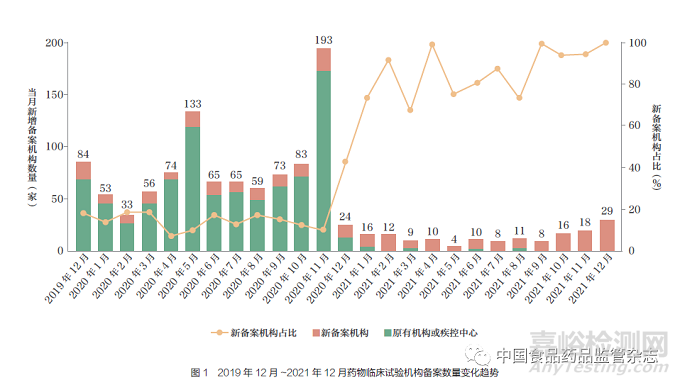
截至2021 年12 月31 日,全国药物临床试验备案机构累计1146 家,是备案制度实施前的1.3 倍。其中有270 家符合新备案机构定义,占备案机构总数的23.6%。在备案制度全面实施前(2020 年11 月30 日)共有971家机构备案,主要为原有机构备案,新备案机构仅占比12.9%(图1)。备案制度全面实施后,新备案机构数量大幅增长,2020 年12 月至2021 年12 月共有175家机构备案, 其中新备案机构145 家,占比82.9%。可见备案制度促进了临床试验机构数量的增长和临床试验资源的扩大。
2.1.2 备案机构等级分布
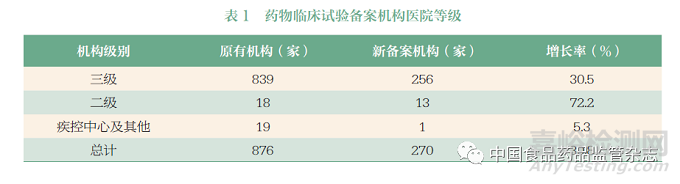
截至2021 年11 月底,全国医院数量为3.6 万家,包含3178家三级医院和10 787 家二级医院[9]。《药物临床试验机构管理规定》中明确了具有二级甲等及以上资质的医疗机构可申请药物临床试验机构备案[3]。但由于综合条件和资源等优势,三级医院依然是药物临床试验机构的主体,占备案机构总数的95.5%。然而,二级医院的备案机构增速明显高于三级医院的增速(72.2% vs30.5%,表1),一定程度上体现了医疗和临床试验资源逐步下沉的趋势。
2.1.3 备案机构地理分布
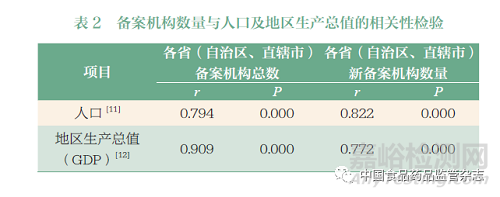
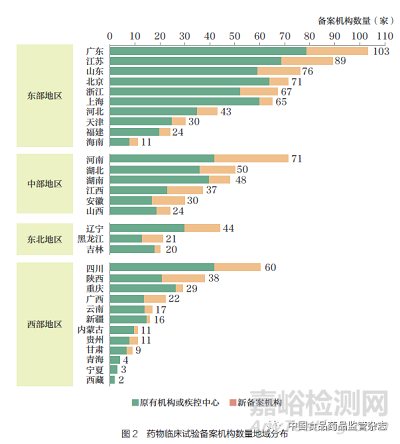
目前我国药物临床试验备案机构依然存在地域分布不均衡的问题。各省(自治区、直辖市)备案机构总数与当地地区生产总值(GDP)呈显著正相关(表2),此现象与既往研究的观察结果具有一致性[10]。此外, 各省( 自治区、直辖市)备案机构总数与GDP 的相关系数高于与人口的相关系数(r = 0.909 vs 0.794),然而新备案机构数量与人口相关系数更高。更大的人口规模意味着对医疗和临床试验资源的更高需求,新备案机构的建设则有助于满足这一需求。按地区来看,东部地区的备案机构总数最多,共有579 家备案机构,占全国备案机构数量的50.5%(图2);中部和东北地区各省(自治区、直辖市)临床试验机构发展较均衡;而西部地区各省(自治区、直辖市)备案机构数量差别较大。对比各省(自治区、直辖市)的新备案机构数量,河南以29 家排名第一。地处西部地区的陕西和中部地区的安徽,新备案机构占比均高于40%。这与原有机构基数较低有一定关系,同时也反映当地对临床试验认知度的提升。总体来说,新备案机构更多倾斜至人口资源更密集的地区,有助于促进地域间临床试验资源均衡发展,更好地满足患者需求。
2.1.4 新备案机构备案专业情况
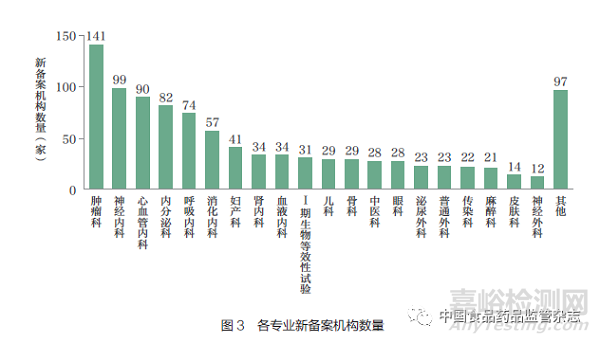
在270 家新备案机构中,备案专业主要集中于肿瘤科、神经内科、心血管内科、内分泌科和呼吸内科(图3)。其中,有141家新备案机构申请了肿瘤科备案,占比52.2%。新备案机构在发展初期倾向于选择重点科室及专业开展临床试验,76.6% 的新备案机构仅备案了1~5 个专业,84.5% 的新备案机构的备案研究者数量少于10 人。
2.2 新备案机构承接药物临床试验情况
2.2.1 试验数量及首次试验登记时间
新备案机构数量占备案机构总数的23.6%,但仅有9.9% 的药物临床试验选择纳入新备案机构,且超过九成的临床试验中新备案机构参与数量不超过3 家。41.5% 的新备案机构在备案后的6 个月内进行了首次临床试验登记公示,17.8% 的新备案机构在备案后的6~24 个月内登记了首次临床试验,但仍有40.7% 的新备案机构在备案后尚未开展药物临床试验。总体来说,新备案机构参与药物临床试验的机会有限,资源尚未达到充分利用。
2.2.2 试验类型及疾病领域分布
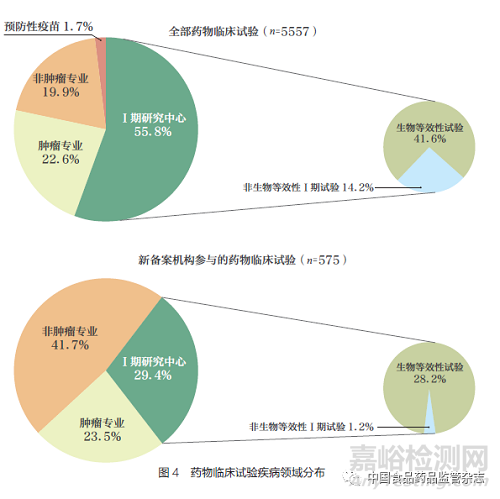
目前新备案机构承接的试验类型和疾病领域均与原有机构存在一定差距。虽然新备案机构承接的试验与全部试验中抗肿瘤试验的占比相似(图4),但新备案机构Ⅰ期研究中心承接的试验数量明显少于平均水平(29.4% vs 55.8%),且以生物等效性试验为主。非生物等效性试验的Ⅰ期临床试验中仅有1.2% 的项目选择纳入新备案机构。此外,中药/天然药物项目仅占全部药物临床试验数量的2.4%,但新备案机构参与程度超过25%。值得注意的是,国内试验和国际多中心试验在新备案机构的选择比例方面并未出现明显区别,分别为10% 和9%。这对新备案机构积累研究经验,加速药物研发规范化、国际化进程起到了积极的作用。
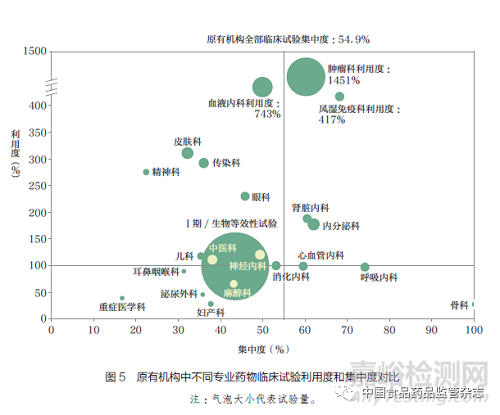
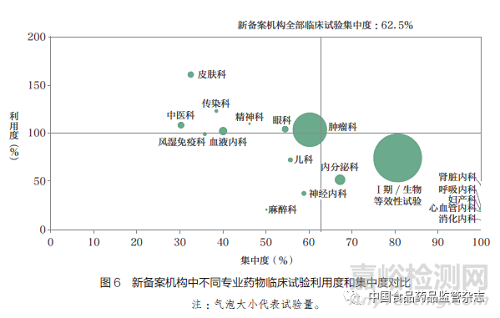
2.3 备案专业在临床试验利用度和集中度分析
了解临床试验机构中不同专业承接试验的情况,对发展学科优势、增强试验承接能力有重要参考意义。图5 和图6 对比了2020~2021 年原有机构和新备案机构承接药物临床试验的利用度和集中度。一方面,新备案机构的平均临床试验集中度高于原有机构(62.5% vs 54.9%)。新备案机构中非肿瘤专业(如心血管内科、呼吸内科、消化内科等)备案数量较多,但临床试验数量少,且项目多集中在某几家机构,导致临床试验集中度接近100%。在项目数量最多的Ⅰ期试验和生物等效性试验中,新备案机构的临床试验集中度也高达80%。另一方面,新备案机构各专业的利用度均低于原有机构( 如肿瘤科103% vs 1451%, 血液内科102% vs 743%)。在原有机构项目竞争激烈且资源较为紧张的情况下(特别是肿瘤科和血液内科),新备案机构仍存在项目不饱和,资源利用效率较低的现象。
3、讨论
3.1 新备案机构促进临床试验资源下沉
药物临床试验机构备案管理的实施有效地促进了医疗资源的释放,新备案机构的医院等级和地理分布均呈现逐步下沉的趋势。虽然三级医院仍是临床试验的主要基地,但二级医院的备案增速明显提高。随着分级诊疗的不断推进,二级医院在慢性疾病管理的优势将逐渐显现,可为相关研究的受试者招募提供解决方案。同时,鼓励二级医院参与多中心临床试验,有助于提高基层医生的诊疗规范和研究水平,加速医疗机构的整体水平的进步。
药物临床试验机构地理分布不均是多篇文献提到的普遍现象[4,13]。在此次分析中发现,尽管备案机构整体分布仍集中在经济发达地区,但各省(自治区、直辖市)新备案机构数量与人口呈现出更强的相关性,且河南、四川、陕西等中西部地区的省份新备案机构数量均高于平均水平。新备案机构倾斜至人口密集或经济欠发达地区,不仅有助于该地区临床诊疗实践和医疗资源向发达地区靠拢,更有利于贯彻落实以患者为中心的药物研发指导理念,让全国各地的患者有同样获得新药临床试验的机会,并减轻患者随访负担。
3.2 新备案机构承接试验存在挑战
完成备案仅仅是机构建设的第一步,临床试验的有效开展才是衡量机构应用价值的指标。目前仅有不到10% 的临床试验选择在新备案机构开展,且机构备案后到开展试验的空档期较长。新备案机构在承接项目上存在困难,一方面源于外界认知不足,行业内尚缺乏有效的宣传、交流机制。另一方面存在自身配置的原因,如缺乏风险控制经验、科室人员对临床试验重视程度不足,以及信息化建设不到位等是多篇文献提到的新备案机构存在的共性问题[14-15]。同时,本研究发现新备案机构备案研究者数量不足也可能是导致机构项目数量有限的原因之一。以肿瘤专业为例,备案研究者数量与试验承接量存在显著正相关(r = 0.824,P = 0.000),可见对研究人员的培养是奠定机构临床试验承接能力的基础。新备案机构可以从机构办公室和专业科室人员培训、临床试验相关信息化建设、对外沟通交流等方面着手,在提高机构宣传度的同时打磨自身能力,达到内外兼修。对于临床研究机构的发展,不仅要追求数量,更要提高各机构的质量,确保产业均衡健康发展。
3.3 根据专业试验供需关系,调整发展策略
目前新备案机构整体利用度有较大提升空间,对处于不同供需关系中的专业,可采取差异性发展计划。对于利用度高但集中度低的专业(如皮肤科),新备案机构参与临床试验的机会较多,供需关系较平衡。新备案机构可考虑对此类专业进行适当资源倾斜和重点发展。对于利用度高且集中度也高的专业(如肿瘤科、眼科),虽然整体项目机会较充足,但试验主要集中在几家机构,其他新备案机构可通过加强宣传、提升专业相关素质等方式,争取参与临床试验的机会。另外,利用度低的专业普遍存在备案机构数量多但试验数量少、新备案机构药物临床试验不饱和的问题。新备案机构在备案此类专业时,也可将其他机构承接试验的现状纳入决策过程,更好地进行计划和准备。
在新备案机构承接的试验中,Ⅰ期临床试验是项目数量最多的专业,但其正在面临低利用度和高集中度的挑战。2020 年1 月1日至2021 年12 月31 日,新备案机构中有31 家建立了Ⅰ期研究中心,开展了Ⅰ期临床试验共计169 个,但其中95% 以上为生物等效性试验,平均项目时长不足3 个月,且试验量排名前3 的新备案机构承接了超过80% 的Ⅰ期临床试验。我国Ⅰ期研究中心项目集中且机构间承接项目能力参差不齐的现象一直存在[16-17]。一方面,Ⅰ期研究中心的建设需要更多资源和人力的投入,Ⅰ期研究中心的临床试验项目间若存在较长的空置期,会增加机构运营成本,降低资源有效利用度,不利于药物临床试验机构的长期发展。另一方面,随着我国医药产业逐渐走向新药研发,生物等效性试验的数量将逐渐减少,对于承接大量生物等效性试验的新备案机构也是一大挑战。提高新备案机构承接Ⅰ期药物临床试验项目的能力,进行更合理的资源配置,是值得重视的发展方向。
4、结语
在我国药物临床试验量不断增加,原有机构资源逐渐饱和的情况下,新备案机构是一个备受关注的群体。新备案机构在医院等级、地理分布等方面,均展现了医疗和临床试验资源逐步下沉的趋势。然而目前新备案机构承接临床试验仍然面临着许多挑战,40.7% 的新备案机构在备案后未开展药物临床试验,承接试验的类型和疾病领域与原有机构间也存在差别。目前许多原有机构中的重点科室仍存在临床试验项目拥挤且资源紧张的问题,新备案机构尚未完全达到释放产能的效果,整体利用度均有提升空间。新备案机构是促进临床试验和医疗资源分配均衡化,带动药物研发行业持续发展的重要途径。建议新备案机构在发展的过程中,除了选择优势专业、提高自身业务能力、加强推广宣传之外,也可根据专业所处的供需关系,针对性调整策略,以更好地适应行业需求,从而获得更多积累宝贵临床试验经验的机会。