您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-02-14 16:23
本文适用于一次性使用医用冲洗器产品。按照《医疗器械分类目录》,一次性使用医用冲洗器产品(以下简称冲洗器),分类编码为14-07-01,管理类别为II类。
一、一次性使用医用冲洗器的结构组成与工作原理
1. 结构组成
目前,冲洗器一般由喷管(如:淋浴状喷管,刷状喷管等)、枪体(含锁环和扳机)、进液管、电源盒和吸引管等组成。典型的产品结构一般包括A锁环、B淋浴状喷管、C枪体、D进液管、E袋装冲洗药液(生理盐水等,非系统的构件)、F刷状喷管、G电源盒、H扳机、J吸引管等部件。产品结构参考示意图见图1。(说明:产品因电源内置或使用网电源等及其他结构性差异,与图示情形可能不完全一致)
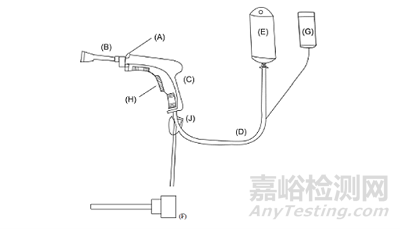
图1 冲洗器结构示意图
2.工作原理
枪体内的微型电机,带动活塞往复运动,使活塞腔内容积发生变化,容积增大冲洗液被吸入,容积变小冲洗液被压出,枪体前端可装配不同类型的喷管,冲洗液通过不同类型喷管后的形态和冲击力会有差异,达到冲洗手术创面的目的。冲洗器枪体内的主要部件有:A电机、B电机齿轮、C皇冠齿轮、D冲洗泵活塞、E齿轮芯轴、F控制器板手、G单向阀垫、H冲洗泵上盖、I管路接头、J管路连接压圈。冲洗器枪体结构爆炸参考示意图见图2。产品配有吸引管路,与吸引器配套使用可同时吸引废液。利用一定压力下的脉动冲洗液流冲洗创面组织,使创面内的细菌、异物等与组织脱离,达到清洁目的。
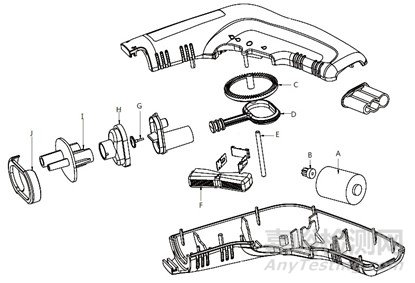
图2 冲洗器枪体结构爆炸示意图
二、一次性使用医用冲洗器的主要风险
以下依据YY/T 0316《医疗器械风险管理对医疗器械的应用》中附录E(表E.1)从各方面列举了冲洗器产品的危险(源)分析。
表1 危险(源)、可预见事件序列、危险情况及伤害示例
|
危险(源) |
可预见事件序列 |
危险情况 |
伤害 |
|
能量危险(源) |
电能(电击危险(源)) |
外壳绝缘性能不良,漏电流值超标,导致外壳漏电流超过安全值。 |
患者触电受伤。 |
|
热能 |
使用环境过热,导致电子元器件发热。 |
患者烫伤。 |
|
|
生物学危险(源) |
组成产品的各原材料有毒性(如:PC料、ABS料、粘合剂等)或环氧乙烷解析不彻底 |
患者接触到还原性物质、环氧乙烷残留量超标的产品。 |
患者机体发热、局部组织坏死,严重时导致死亡。 |
|
产品内有细菌污染,如产品灭菌不彻底、注塑包装材料和过程不符合要求等 |
患者接触到细菌污染的产品。 |
引起患者感染,严重时导致死亡。 |
|
|
产品有热源,如生产过程中初始污染菌超标或原材料热源超标 |
患者接触到有内毒素的产品。 |
患者发生热源反应,严重时死亡。 |
|
|
包装材料老化、破损等致使产品染菌和引起毒性 |
患者接触到有毒性或细菌污染的产品。 |
引起患者感染,严重时导致死亡。 |
|
|
产品与药物不相容 |
患者接触到失效或有毒性的药液。 |
无法达到清洗伤口的目的,严重时导致死亡。 |
|
|
环境危险(源) |
电磁场 |
冲洗器使用时与射频通讯设备距离低于安全距离,或周围电磁环境超出普通商业或医院环境允许值。 |
产品使用时受到电磁干扰无法运行,影响手术进程。 |
|
储存或运行偏离预定的环境条件 |
设备本身不能满足规定的环境条件要求或工作环境得不到满足。 |
设备不能够正常运行。 |
|
|
由不正确的能量和物质输出所产生的危险(源) |
电能 |
连接中断时设备可触及部分带电。 |
电池短路、发热、爆炸。 |
|
与医疗器械使用有关的危险(源) |
不适当的操作说明 |
冲洗器没有使用说明书和技术说明书,或其内容不全。如缺少必要的警告说明、缺少详细的使用方法、缺少必要的技术参数、缺少电路图和元器件清单、缺少运输和贮存环境条件的限制。 设备在单一故障状态下运行。 |
产生危险。 |
|
产品有效期标识不清晰 |
患者接触到过期有菌产品。 |
感染,严重时导致死亡。 |
|
|
库房储存环境不符合要求 |
产品材料老化。 |
感染,延误治疗。 |
|
|
一次性使用标识不清晰 |
产品被重复使用。 |
感染,严重时导致死亡。 |
|
|
产品说明书中没有明确安全使用注意事项 |
医务人员不能正确使用产品。 |
延误治疗。 |
|
|
提供的安全信息不完整或不规范 |
出现危险操作。 |
影响手术进程,危害患者健康。 |
|
|
功能的丧失或变坏 |
连接部位不密封,冲洗液体渗漏,或不能回吸废液。 |
影响手术进程,危害患者健康。 |
三、一次性使用医用冲洗器性能研发实验要求
1.一次性使用医用冲洗器主要技术指标
1.1外观要求
1.2性能指标
1.2.1锁环应能锁紧枪头,无松动现象。
1.2.2冲洗控制应灵敏可靠,无卡壳现象。准确控制开启和停止。
1.2.3明确可用喷管形状,喷出液体形态。如:选淋浴状喷管时,可喷出呈圆锥状液体;选刷状喷管时,可喷出呈圆柱状液体。
1.2.4明确在具体条件前提下,可控制喷射出的液体距离和流量。
1.2.5吸引管路应具有控制吸引的功能。
1.2.6连接部位应密封,牢靠无松脱。
1.2.7对重要零部件的关键尺寸进行明确。
1.3化学性能
1.3.1可萃取金属含量
1.3.2酸碱度
1.3.3易氧化物
1.3.4环氧乙烷残留量(如适用)
1.4无菌
1.5安全性能:符合GB 9706.1的要求。
1.6电磁兼容:应符合YY0505的要求。
2.一次性使用医用冲洗器材料要求
2.1进液管和吸引管
对于采用医用PVC (软聚氯乙烯)的材料,管材应符合GB 10010《医用软聚氯乙烯管材》标准要求;瓶塞穿刺器应符合GB 8369《一次性使用输血器》标准要求。
2.2喷管
对于采用医用聚丙烯的材料,应符合YY/T 0242《医用输液、输血、注射器具用聚丙烯专用料》标准要求。
3.一次性使用医用冲洗器性能研究
开展产品性能研究以及产品技术要求的研究,明确功能性、安全性指标(如电气安全与电磁兼容)以及与质量控制相关的其他指标,所采用的标准或方法、采用的原因及理论基础。
4.生物相容性评价研究
对成品中与患者和使用者直接或间接接触的产品部件,应当按GB/T 16886.1规定的原则进行生物相容性评价。
生物相容性评价研究应当包括:明确生物相容性评价的依据和方法;明确产品所用材料及与人体接触的性质;明确实施或豁免生物学试验的理由并论证;对于现有数据或试验结果的评价。提示:应关注液路部件材质,性能,标准等要求。
5.灭菌/消毒工艺研究
5.1灭菌确认、包装研究(无菌部件)
5.1.1生产企业灭菌:明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并开展灭菌验证及确认的相关研究。
5.1.2使用者灭菌:产品为无菌交付,一次性使用,不适用使用者灭菌。
5.2残留毒性:若产品经灭菌或消毒后可能产生残留物质,应当对灭菌或消毒后的产品进行残留毒性的研究,开展研究明确残留物信息及处理方法。
6.稳定性研究
6.1货架有效期
应当开展货架有效期和包装研究,证明在货架有效期内,在生产企业规定的运输贮存条件下,产品可保持性能功能满足使用要求,具有微生物限度要求的产品还应当符合微生物限度要求,以无菌状态交付的产品还应保持无菌状态。
6.2使用稳定性
应当开展使用稳定性/可靠性研究,证明在生产企业规定的使用期限/使用次数内,在正常使用、维护情况下,产品的性能功能满足使用要求。
6.3运输稳定性
应当开展运输稳定性和包装研究,证明在生产企业规定的运输条件下,运输过程中的环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。
7.其他研究
该产品是《免于临床评价医疗器械目录》产品,开发应当按照《列入免于进行临床评价医疗器械目录产品对比说明技术指导原则》,从基本原理、结构组成、性能、安全性、适用范围等方面,证明产品的安全有效性。

来源:嘉峪检测网


