摘 要 Abstract
脂质纳米颗粒(LNP)递送技术的突破,推动了RNA 疗法的发展,受到了广泛关注。mRNALNP制备是mRNA 疫苗从纯化mRNA(原液)到成品(制剂)的生产过程的关键步骤,涉及脂质制备或筛选、mRNA 包封/ 装载、纯化等工序,目前最常用的方法是将水相和脂质成分快速混合的微流控法。基于LNP 自组装的特点,本文梳理了微流控条件下mRNA-LNP 制备的考虑要点。首先,在制备过程中,各脂质成分比例、脂质和水相的流体动力学、pH 值控制、缓冲液的选择与LNP 颗粒大小、形态、封装效率和表面电荷等关键质量属性息息相关,需要不断探索mRNA-LNP 制备的关键工艺参数和最佳操作范围。其次,还应关注mRNA 在被包封到LNP 过程中的降解问题,以及生产过程中mRNA 原液的任何变化对LNP 的影响。此外,本文还提出了针对含有多种mRNA 分子的疫苗(如自我扩增型mRNA 疫苗和多价疫苗)中LNP 制备的考虑要点,以期为国内相关企业在mRNA 疫苗制剂生产质量控制方面提供有益参考。
The breakthrough of lipid nanoparticle (LNP) delivery technology has promoted the development of RNA-based therapies, which has attracted extensive attention. The preparation of mRNA-LNP is a key step in the manufacturing process of mRNA vaccine from the bulk purified mRNA (drug substance) to the final vaccine (drug product), which involves lipid preparation and screening, mRNA encapsulation/loading, purification and other processes. The most common method for mRNA-LNP preparation is to rapidly mix the aqueous phase and lipid components by microfluidic technology. Based on the characteristics of self-assembly of LNP, some considerations on the preparation of mRNA-LNP under microfluidic conditions were summarized in this article. Firstly, it was found that some important parameters in process such as the proportion of each lipid component, flow dynamics of the lipid and aqueous phase, pH control,and the selection of buffer would be closely related to the key quality attributions of LNP, for example, particle size, morphology, encapsulation efficiency, and surface charge. Therefore, it is necessary to continuously explore the critical process parameters and their operational ranges optimal for mRNA-LNP. Secondly, specific attention should be given to degradation of the mRNA during encapsulation into the LNP and the impact of any change related to the mRNA drug substance on the critical quality attributes of the LNP. In addition, this article raised some concerns about the preparation of LNP in final vaccines containing multiple mRNA species such as selfamplifying mRNA vaccines and multivalence mRNA vaccines. It is hoped that these considerations will provide useful reference for domestic enterprises in the quality control of drug products of mRNA vaccines.
关键词 Key words
脂质纳米颗粒;mRNA 疫苗;制剂;质量控制
lipid nanoparticle; mRNA vaccine; drug products; quality control
mRNA 疫苗因其抗原设计简单、适应性强、具有诱导体液免疫和细胞免疫应答的潜力,以及具有高效、快速、低成本的生产特点,在疫苗领域引起了一场巨大的革命。已有多种mRNA 疫苗被用于传染性疾病和癌症的研究,并显示出一定的优越性。而作为在新冠肺炎(COVID-19)大流行期间首批进入临床开发的候选疫苗, 两款COVID-19 mRNA疫苗——BNT162b2 和mRNA-1273,凭借Ⅲ期临床试验中约95% 的有效性[1-2],被一些国家或地区的监管机构批准用于紧急使用,以抗击新冠肺炎疫情[3-4]。其中,BNT162b2 是首个被列入世界卫生组织(WHO)紧急使用清单的mRNA 疫苗[5]。截至2022 年9 月, 全球共有371个COVID-19 候选疫苗处于开发阶段,其中属于mRNA 技术路线的有65 个,40 个已进入临床试验阶段[6]。随着COVID-19mRNA 候选疫苗临床试验进展的不断推进, WHO[7]、美国食品药品监督管理局(FDA)[8]、欧洲药品管理局(EMA)[9]、我国国家药品监督管理局药品审评中心(CDE)[10] 等监管机构陆续发布了相应的指南,旨在规范和指导对此类产品的申报。其中,WHO近期发布的《关于预防传染病mRNA 疫苗质量、安全性及有效性评估的法规考虑》(Evaluation ofthe Quality, Safety and Efficacy of Messenger RNA Vaccines for the Prevention of Infectious Diseases:Regulatory Considerations)[7] 是针对mRNA 产品的首个全球性法规,对于指导各国(地区)监管当局评价此类产品、明确监管要求具有重要指导意义。本文基于已上市RNA 产品生产工艺的主要特点,结合最新的WHO 法规要求,以及当前mRNA 脂质纳米颗粒(mRNA-LNP) 设计、生产和应用特点,对mRNA-LNP生产过程中的质量控制考虑要点进行了梳理。
1、mRNA-LNP 的应用进展
脂质纳米颗粒(lipidnanoparticle,LNP) 通常由多种脂质组成,用于包封mRNA 和增强其稳定性的递送系统,可以避免mRNA 在细胞外降解,促进其被细胞摄取和释放到细胞质中。脂质成分包括但不限于可电离/ 阳离子脂质、辅助脂质[ 如中性脂质和(或)胆固醇] 和通过聚乙二醇化(PEGylation)修饰的脂质[7]。LNP 的出现对RNA 疗法的发展具有里程碑式的意义,成功解决了对RNA 进行保护和递送的难题。目前,基于病毒和非病毒的载体都已被开发用于RNA的递送。其中,基于病毒的载体主要包括逆转录病毒载体、慢病毒载体、腺病毒载体和痘病毒载体[11]。通常,基于病毒的载体通过病毒感染途径侵入细胞,因此它们具有基因导入效率高、基因定点传递、免疫反应增强等优点,但也存在致突变、致癌等缺点[12]。与病毒载体相比,非病毒载体(如鱼精蛋白复合物,阳离子脂质体和基于脂质、聚合物或脂质/ 聚合物的纳米颗粒等)表现出更好的灵活性和安全性[13-14],而LNP由于具有相对容易和可规模化的生产方式, 现已被用于前沿的mRNA 候选疫苗和广泛使用的新型冠状病毒疫苗。
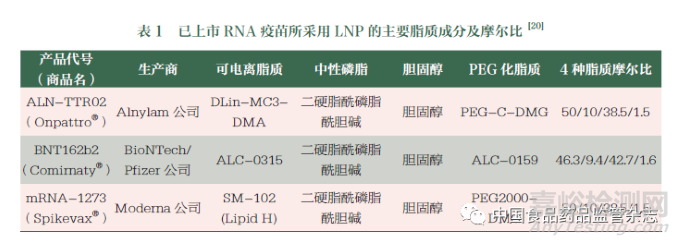
可电离的阳离子脂质(ionizable lipids,ILs) 的开发使实现RNA 细胞质递送成为可能。最早的LNP 制剂是于2018 年上市的siRNA 疫苗Onpattro®,其前身是包裹质粒DNA 的质粒脂质颗粒(SPLP)[15],后进一步发展为含有小干扰RNA(siRNA)的稳定化核酸脂质颗粒(SNALP)[16],再经过对阳离子脂质的一系列优化和筛选后获批上市。作为首个使用ILs 的RNA上市药品,ALN-TTR02 包含对pH 值敏感的ILs( DLin-MC3-DMA),其被设计成在酸性pH 条件下质子化呈正电性,而在生理pH 条件下几乎呈中性。与阳离子脂质相比,ILs 不仅有利于在酸性pH 条件下与带负电荷RNA 发生静电相互作用,还能够诱导内体逃逸和降低细胞毒性[17]。换句话说,可电离的LNP 不易被网状内皮系统识别然后被去除[18]。进入内体后,可电离的LNP 在内体的酸性环境(pH 值为5~6) 中带正电荷,并自发地与阴离子内体脂质融合,从而将RNA 释放到细胞质中。当ILs 的解离常数(pKa) 值介于6.2~6.5 之间时,通过静脉注射途径可以实现靶向肝脏的最佳效率[19]。此后上市的两款COVID-19 mRNA 疫苗显然借鉴了Onpattro®的纳米平台技术,但分别对ILs 进行了优化。在mRNA-1273 的开发中, 考虑到Onpattro® 中DLin-MC3-DMA 的缓慢降解可能导致潜在的毒性,Moderna 公司开发了一类新型可电离脂质SM-102,以替代DLin-MC3-DMA [20] ;而BNT162b2 也同样基于上述考虑,使用了Acuitas 公司的可电离脂质ALC-0315[20]。上述两款COVID-19 mRNA 疫苗的脂质均由ILs、PEG 化脂质、中性脂质和胆固醇组成,但4 种脂质的摩尔比相对不同,具体见表1。
2、mRNA-LNP 的制备
LNP 的制备依赖于自组装能力,即脂质成分发生分子间相互作用而自发组织成纳米结构实体。在mRNA 疫苗中,带负电荷的mRNA 和带正电荷的可电离/ 阳离子脂质之间通过静电相互作用结合,再通过脂质组分之间的疏水作用和范德华作用进行组装,进而形成mRNA-LNP 复合物。该过程是从纯化mRNA(原液)到成品(制剂)的生产过程的关键步骤,涉及脂质制备或筛选、mRNA 包封/ 装载、纯化等工序[10]。
2.1 脂质制备或筛选
应对所选择脂质的来源和纯度进行表征。例如, 对于动物源性( 包括人源性) 材料,应符合现行的《WHO 与药品生物制品相关的传染性海绵状脑病指南》(WHO Guidelineson Transmissible Spongiform Encephalopathies in Relation to Biological and Pharmaceutical Products)[21] 的相关要求;对于潜在外源因子,应提供相关支持性证据和风险评估结果,确保其已被去除或得到控制[7] ;对于此前未开展过非临床或临床研究的新型脂质,应提供其生产工艺和检定、遗传毒性和系统毒性评估的详细信息[7]。最后,对于由脂质产生的潜在杂质(与工艺和产品相关),应就其临界值进行论证,以便能够对其适当检定和达到临床接受范围[7]。
在对4 种脂质成分的筛选中,ILs 是最关键的,它是影响mRNA 递送和转染效率的决定性因素。如上所述,需要将ILs 设计为对内体酸化反应敏感[22]。因此,pKa 被视为筛选的重要指标。此外,为提升递送效率,通常还需要考虑ILs 的分子形态(优先考虑锥形结构)和可降解性。中性辅助磷脂一般为饱和磷脂,可提高阳离子脂质体的相变温度,支持层状脂质双层结构的形成并稳定其结构排列,常用的有二硬脂酰磷脂酰胆碱(DSPC)、二油酰磷脂酰乙醇胺(DOPE) 等。胆固醇有较强的膜融合性,促进mRNA 胞内摄入和胞质进入。研究表明,当LNP 递送系统不含胆固醇时,其稳定性和效力均有所下降[23]。PEG 化脂质位于脂质纳米粒表面,其含量决定颗粒的大小,主要用于改善LNP 亲水性,避免其被免疫系统快速清除,防止颗粒聚集,增加稳定性。不同于其他脂质,研究发现,过多的PEG 会对LNP 的细胞摄入和转染产生不利影响[20,22-23]。因此,PEG 化脂质被设计成最终会发生解离并使PEG 脱落。通过调整4 种脂质的比例,可以改变LNP的理化属性,如颗粒大小、形态、封装效率和表面电荷,从而更好地适应接种的组织[24]。
2.2 mRNA 包封/ 装载
目前, 绝大多数LNP 的合成主要基于自组装的原理。“自组装”的概念来源于材料学,是指由非共价相互作用驱动的单个分子自发排列成超分子组装体[25],其最主要的特点是可以通过简单的组分混合来完成制备,并且通过微调单个组分可以改变整个复合体的理化特性[22]。虽然上述两款COVID-19mRNA 疫苗自组装的技术细节尚未公布, 但Moderna 公司发布的关于交错人字形微流体混合器(staggered herringbone micromixer, SHM)[26-28] 和乙醇纳米沉淀(ethanol-dropnanoprecipitation)[29-30] 的研究,以及关于BNT162b2 的研究[31-32]表明, 两款COVID-19 mRNA疫苗采用的LNP 是由脂质的乙醇相溶液通过渗滤转移到水相缓冲液中形成的。此外,一些研究亦证实了利用微流体通过两相溶液混合包封形成mRNA-LNP 的可行性[30,33-35]。微流体技术被认为是一种适用于《药品生产质量管理规范》(Good Manufacturing Practice,GMP)设施的可扩展系统,能够高度控制和提供可重复的混合力,对于混合毫升(ml)级别剂量的溶液十分有效[22,36]。此前,SHM 被广泛使用,其常规流速为12ml/min[37]。但当生产规模扩大后,单个SHM 通常难以达到GMP 所需的高通量速度[38]。这导致需要同时使用多个SHM才能实现更高的生产量,其质量控制的难点是需要确保多个SHM具备相同的关键质量属性,如粒径大小、分散系数和包封率[39-41]。而后续研发的环形微流体混合器(TrM)有效地解决了上述问题,它保留了SHM 的非湍流平流混合,同时通过增加混合器尺寸,使单混合器的流速提高到近200ml/min, 并保持了mRNALNP的关键质量属性[18,42],确保临床前生产规模扩大后的兼容性,并简化了工艺放大过程。LNP 的制备原理主要是通过两相溶液快速混合包封形成复合物,首先需要将4 种脂质和纯化后的mRNA 原液分别溶于有机相溶液和酸性水缓冲液。随后,将两相溶液按照适当比例进行快速混合。在该过程中,酸性溶液会促使脂质中的可电离脂类离子化而呈正电性,从而实现与带负电荷的mRNA 结合形成有效包封。与此同时, 随着对乙醇相溶液的稀释, 脂质的溶解度不断降低并逐渐析出凝固, 从而形成在水相溶液中包裹mRNA 的脂质颗粒[43]。
2.3 复合物的纯化
在对mRNA 进行包封后,需要使用切向流过滤(TFF)进行纯化,其目的是去除未包封的mRNA、游离的聚合物或脂质材料,以及mRNA 和脂质溶剂等。在此过程中,通常选择具有适当截留分子量(MWCO)的超滤膜,以确保mRNA-LNP 复合物无法通过滤膜。此外,除菌过滤是保障疫苗制剂无菌性的重要步骤,通过除菌级过滤器,使细菌等微生物、污染物和杂质在过滤器中被截留并随其丢弃[44]。
3、微流控条件下mRNALNP制备的质量控制
如上所述, 在微流控条件下,基于LNP 具有自组装的特性,可以通过将水相和脂质成分快速混合来完成mRNA-LNP制备。该方法的优势是可以通过建立相关控制操作条件的关键工艺参数和最佳操作范围,实现对LNP 理化特性的精确控制,以确保mRNA-LNP 生产的一致性。
3.1 对脂质比例的考虑
在LNP 合成过程中,脂质是必不可少的辅料成分。研究表明,各脂质成分比例的细微差异都可能会影响LNP 的理化属性,如颗粒大小、形态、封装效率和表面电荷的改变,进而导致不同的安全性[23]。因此,应监测脂质摩尔比或阳离子脂质与mRNA 比例(如氮磷比)的变化情况,这也是确定产品一致性和稳定性的重要指标。
3.2 总流速和流量比
两相溶液总流速(total flowrate, TFR)和流量比(flow rateratio, FRR)是影响混合的两个重要参数。如前所述,mRNA 包封/ 装载的方式是将有机溶剂中的脂质与含有核酸的水相混合,而TFR 和FRR 决定了所形成LNP的粒径大小。通过对多个阳离子脂质体对比发现,无论怎样选择阳离子脂质,LNP 的粒径大小都会随混合流速的增加而减小,例如, 当TFR 从5ml/min 增加到10~20ml/min 时,LNP 的粒径会逐渐减小并趋于稳定[18]。同时研究还发现,在混合溶液中,随着FRR 的增大,即水相溶液与有机相溶液比例的增大,也会导致LNP 的粒径变小[18]。其原因是在混合过程中受到脂质和水相的流体动力学和剪切力的共同影响[7],更高比例的水相溶液和更快的流速有助于减少粒子融合而形成更小的粒子[45]。由此可见,通过对FRR 和TFR 等微流体操作参数的控制,可以准确地生产所需要的LNP,这对于确保生产一致性至关重要。
3.3 对pH 值的控制
ILs 在酸性pH 条件下带正电荷、在生理pH 条件下呈中性的特性[46],是确保LNP 的形成与mRNA 包封同步完成的关键。在酸性环境中,ILs 官能团通过质子化携带正电荷,同时由于其在水相溶液中具有疏水性,能够驱动囊泡(vesicles)的形成以及与带有负电荷的mRNA 的封装。最初的囊泡形成后,随着被进一步稀释、透析或过滤,溶液pH 值升高,中性环境可使脂质具有更强的疏水性,从而推动囊泡融合,导致可电离脂质与mRNA 被进一步隔离到固体LNP 的内部[47]。在该过程中,pH 值的变化在mRNA包封过程中发挥了重要作用,当两相溶液混合后,pH 值介于水相缓冲液的pH 值与可电离脂质乙醇缓冲液的pH 值之间。因此,应确保初始混合溶液的酸性环境,并对稀释过程中pH 值的变化进行精准控制。此外,pH 值环境的不同,亦对LNP 粒径大小产生影响。研究发现,在酸碱中和过程中,siRNA-LNP 形态也在不断变化,在pH 值为 4 的酸性条件下融合成的颗粒粒径较小,但在pH 值为7.4 的碱性条件下,在透析过程中会融合成粒径较大的电子致密颗粒[48]。
3.4 缓冲液的选择
混合过程通常还需要使用缓冲剂、渗透剂和低温保护剂等其他辅料。例如,Moderna 公司采用Tris-HCl 缓冲液作为羟基清除剂,对mRNA 提供额外的稳定作用[47]。不同的缓冲液对LNP 的关键质量属性也会产生影响。例如,研究发现,在使用溴化三甲基-2, 3- 二油酰氧基丙基铵(DOTAP) 制备阳离子脂质纳米颗粒(cationic lipid nanoparticle,cLNP) 时, 使用Tris 缓冲液产生的cLNP 比使用枸橼酸盐缓冲液产生的cLNP粒径更小、分散系数更高,同时,两者也显示出不同的Zeta 电位[18]。因此,对于缓冲液的使用及其影响,应在mRNA 制剂工艺设计中加以考虑。
3.5 mRNA 原液的考虑
基于裸露mRNA 的不稳定性,LNP 中mRNA 的包封率/ 比例也应被视为关键质量属性。mRNA 疫苗的剂量取决于mRNA 的含量,因此需要特别关注并最小化mRNA 在被包封到LNP 过程中的降解问题,以及生产过程中mRNA 原液的任何变化(如序列、长度或二级结构的变化)可能对LNP 的关键质量属性(如粒径大小和分布、形态以及表面特性)产生的影响[7]。为此,应对混合工艺一致性进行验证,确保LNP 中mRNA 的包封率/ 比例符合预期标准。
4、对含有多种mRNA分子的疫苗中LNP 制备的考虑
对于含有多种mRNA 分子的疫苗, 如联合疫苗、多价疫苗或自我扩增型mRNA(self-amplifying mRNA,samRNA)疫苗,在生产时应给予更多关注和考虑。例如,对于samRNA疫苗,应结合其不同的产品类型分别进行考虑。对于病毒复制子与目的抗原基因在同一个读码框的sa-mRNA,其配制成LNP 的生产方法和质量控制方法与非自我扩增型mRNA 疫苗大致相同。然而,对于病毒复制子在单独的读码框中的sa-mRNA,其编码复制子的mRNA 和表达目标抗原的mRNA 可能被编码在不同的分子上。因此,在mRNA 包封/ 装载过程中,重要的是应将上述两种mRNA 包封在一起,以便其在体内可以被同一个细胞吸收。这需要采用额外的生产工艺和质量控制方法,如考虑两个被包封mRNA 的摩尔比,以确保所需mRNA 被充分包裹在相同LNP 中[7]。对于联合疫苗或多价疫苗,应考虑确保LNP 制备过程中不同种类mRNA 的适当比例,优化每种mRNA 的表达,最小化免疫干扰问题。另外,还应考虑mRNA 在被包封到LNP 之前是否被混合,或者是否每个mRNA被单独包封到LNP 后,再将所形成的两个或更多mRNA-LNP 混合。总之,无论是哪种情况,都应结合相关数据进行说明和验证[7]。
5、结语
随着Moderna 公司和BioNTech/Pfizer 公司成功开发了COVID-19 mRNA 疫苗,mRNA 平台技术和LNP 受到前所未有的关注。我国《“十四五”医药工业发展规划》[49] 明确提出,要针对潜在传染病风险,加快建立核酸疫苗等新型疫苗技术平台,满足应急研发和生产需求。与此同时,国内3 家企业自主开发的mRNA 疫苗已经进入临床研究阶段,另有至少7 家企业也在积极推进mRNA 技术的应用[50]。尽管mRNA 疫苗是一项新技术且生产相对简单,但其中很多工艺的质量控制是非常复杂的,且在此类产品的风险评估方面仍需要开展大量研究工作。本文介绍了mRNA 制剂工艺的主要流程及工艺特点,结合WHO 技术指南和近期相关研究进展,梳理分析了mRNA 疫苗制剂过程控制中的关键考虑要点,以期为国内mRNA疫苗制剂研发企业提供参考。