您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-07 21:24
近年来,药物发现领域的科学家们研究了许多非常有效的小分子候选药物,但此类药物的药理作用有效剂量可能非常低。这种低剂量药物给产品设计和优化方面提出了重大挑战。在新的监管环境下,如何在提高产量的同时确保产品的质量和安全,是这类药物的又一巨大挑战。
1、低剂量药物概念及特点
新药制剂开发中,当药物开发剂量较低,可能导致其制剂中载药量极低。根据MCS可知,当制剂中载药量极低,制剂中间体及终产品的相关物理性质,如中间颗粒的可压性,流动性等,受API不良的理化性质的影响降低。可是,当制剂剂量低至一定的程度,又会带来新的问题与挑战。
低剂量药物制剂中的活性成分通常为高活性药物,具有生物利用度高、治疗窗狭窄等特点。低剂量药物制剂是指载药量在1%(美国药典)、2mg或2%(英国药典)以下的制剂。
低剂量药物制剂一般具有如下特点:
极低的单元药物含量;
辅料/药物比例大(可高达500至50000);
生产过程中极易遭受损失与污染;
要求灵敏度极高的分析方法和极为精细的前处理方法,并获得较好的回收率;
很可能是BCSⅠ类或Ⅲ类药物;
终产品的含量均匀性与生产贮存中产品的稳定性要求较高等。
低剂量药物所具有的特点也决定了制剂处方工艺开发中可能遇到的问题:
understanding patients’ needs;
selecting manufacturing platform technology;
achieving blend uniformity;
achieving dosage unit uniformity;
understanding critical product quality attributes;
controlling critical process parameters;
understanding process analytical technology (PAT);
controlling excipients for manufacturability and product stability;
optimizing container/closure system for product stability;
achieving quality by design (QbD) and risk assessment
面对低剂量的药物的规定,对于规格稍大制剂,例如5mg规格,是不是不具有以上的风险或者问题了呢?
2、低剂量药物开发难点问题及解决办法
从工艺上来看,低剂量药物极易造成终产品的含量均匀性问题。图1模型建立了API规格与API粒度的对应关系以满足终产品含量均匀性符合要求。根据制剂确定的规格以及测定的API粒度分布符合对数正态分布的情况下的几何标准差sg,可以根据模型推测合适的API粒度分布。如对于1mg规格的制粒,几何标准差sg=4,大概可以推算出API粒度约为8μm比较合适。对于上述预测模型,可以给出API粒度的限定及处理方式的选择提供依据。
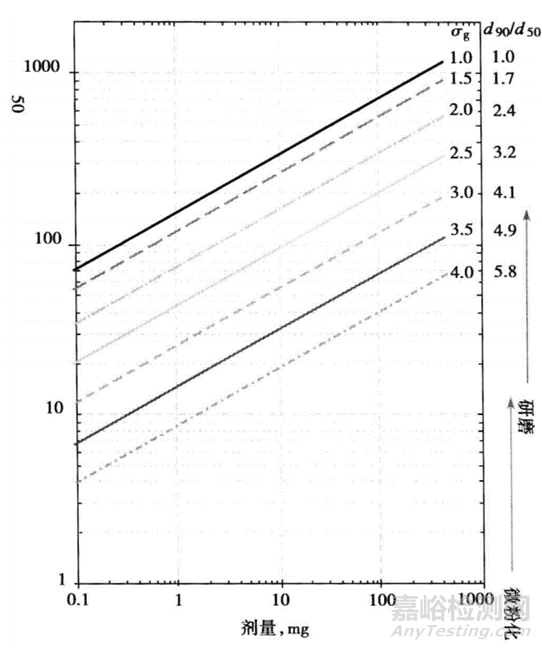
图1 活性药物成分粒径分布符合对数正态分布的情况下,符合美国药典规定的含量均匀度要求的预测颗粒最大几何平均体积径与剂量(mg)及几何标准差的函数关系
当然,从图1可知,规格越小,粒度几何标准差越大,可能需要的API的粒度就越小,才能满足最终产品含量均匀性的要求。从风险评估的角度来看,不是开发规格在低剂量定义以上,其就远离了低剂量药物所面临的挑战,只是可能开发的难度降低,风险减小。
对于低剂量的品种来说,微粉化API的能力对于获得均匀的固体药物产品的可能性至关重要,因为低剂量需要尽可能微粉以产生更多份数的API与辅料进行充分的混合。如果化合物不能被微粉化或在研磨过程中发生多晶型变化,那么这种API的处理方式可能是不可行的。
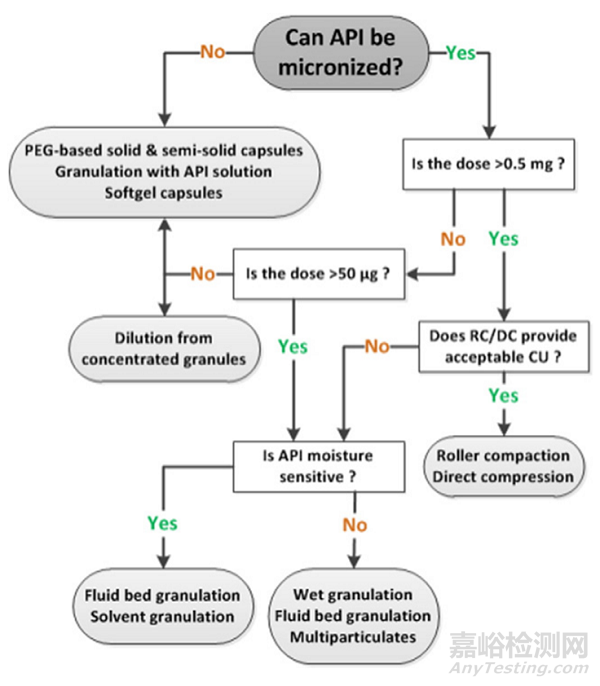
图2 低剂量药物决策树
图2详细介绍了低剂量药物开发工艺选择。
首先判断API能否进行微粉化,如果化合物不能微粉化,则必须考虑涉及药物溶解的策略。例如,将处方量的API溶解在熔融的聚乙二醇(PEG)或Gelucire脂质基质中。然后将熔融的混合物填充到胶囊中,或者将辅料与溶解的药物融为一体,或者将其用作粘合剂以获得颗粒。随后可以将它们装入胶囊或压制成片剂。溶解在胶囊填充基质中的药物需要与外壳材料相容。此处通常使用不同极性的基于脂质的系统。当胶囊装满液体时,可以实现极好的内容物均匀度。
对于可以微粉的API,开发剂量大于0.5mg,可能会开发DC(直压)或RC(碾压)工艺,这是大多数制药公司常用的技术平台。在这两个过程中,压片或碾压前的混合均匀性是关键。必须通过仔细选择辅料和混合过程来获得具有有限分离趋势的均匀混合物。造粒技术通常会降低混合物的离析可能性并改善整体流动性。
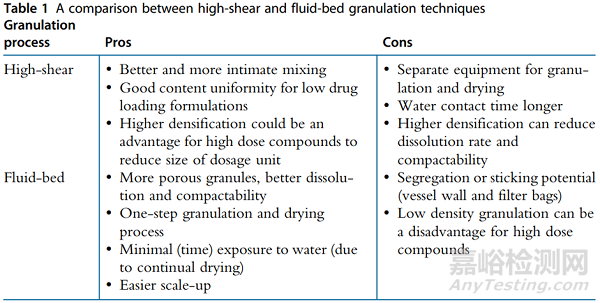
对于不适用于DC/RC,或者开发剂量在50-00μg的药物,在其对于湿稳定的情况下,可以选择湿法制粒或者流化床制粒。倘若药物对于湿气敏感,可以采用有机溶剂制粒或者流化床制粒。与湿法制粒相比,流化床制粒与湿度接触的时间更短,当在两者中进行抉择时可以首选流化床制粒。
从工业和监管的角度来看,有机溶剂制粒的主要缺点是所有化合物首先溶解,然后在溶剂蒸发时沉淀。不断演变的固态形式对于最终药物产品的质量属性变得至关重要,因为该方法可能导致形成另一种多晶型甚至无定形材料。API晶型稳定性具有风险。
对于API含量非常低的药品(图2将其定义为低于50μg),所有上述处方策略原则上都可以使用,即使在极低剂量下很难获得合适的含量均匀性。避免这种情况的一种可能是通过生产一种API含量相对较高的颗粒,然后将其与安慰剂颗粒混合,然后压制成片剂或填充到胶囊中。对于非常低的剂量,应评估将药物溶解到溶剂或聚合物中的可能性,也可用于胶囊的液体填充。
3、低剂量药物的辅料选择
除了上述介绍通过预测的办法去选择API的粒度去满足低剂量药物的含量均匀性,还可通过API的理化性质去选择合适开发工艺;对于低剂量药物来说,选择合适的辅料也很重要。
奥氮平是美国礼来公司研发的非典型抗精神病药,属于生物药剂学分类系统 (BCS) Ⅱ类药物。因其溶解度小、在制剂中占比低,原研片剂采用湿法制粒工艺。“利用乳糖载体吸附性改善粉末直压奥氮平片的混合均匀度”文章做了一个这样的设计,制备了API载量为2.5%的处方,药物载量较低具有混合均匀性和含量均匀性的风险,而且欲采用粉末直压工艺,风险值直接拉满。通过不同型号的乳糖筛与API混合,发现圆形表面粗糙的喷雾干燥乳糖吸引API颗粒填充到表面的孔隙和沟槽中,且多重覆盖,减少了自由API颗粒团聚的风险。

图3 不同类型乳糖载体与微粉化混合前后SEM图像的对比(左侧图片分别为A1、B1、C1为乳糖F100、T80 和 T100,右侧为其与API混合物)
文章中还介绍了通过制备不同粒度API与乳糖进行混合,研究发现,随着API原料药粒径的减小,预混物的混合均匀度越好,其实与上文预测是相一致的,结果见图4。
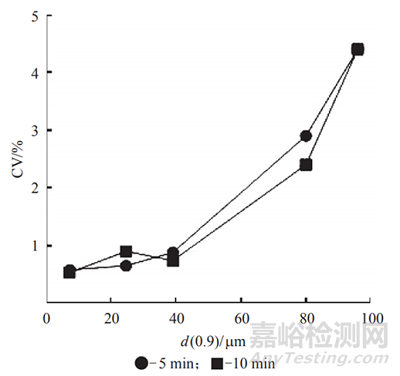
图4 粒度对中间体颗粒含量均匀性的影响
4、小结
对于低剂量药物来说,为了满足其混合均匀性和含量均匀性,常常采用微粉或者其他粒度降低的办法。但是,微粉API也是一项耗能的工序,而且在给API带来损失的前提下,也带来物理化学稳定性的风险。制剂的开发总是遇到两难的问题,也总是在抉择中不断推动项目往下进行……
参考文献
1. Methodology of oral formulation selection in the pharmaceutical industry
2. 利用乳糖载体吸附性改善粉末直压奥氮平片的混合均匀度_黎玄哲
3. A Quality By Design Approach to Scale-Up of High Shear Wet Granulation Process
4. Formulation and Analytical Development for Low-Dose Oral Drug Products(书籍)
5.Martin物理药剂学与药学(书籍)
6. 低剂量固体药物制剂的质量控制要点

来源:药渡


