您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-01-24 14:27
2021年,中国医药制造业保持高速发展态势,研发创新实力稳步增强,产业结构进一步升级,“三医联动”政策逐步完善,四大生物医药产业集聚区战略布局与政策环境建设持续优化,资本市场活跃度显著提高。
展望2022年及“十四五”,在全球化进程加速发展,以国内大循环为主体、国内国际双循环相互促进的国家战略要求背景下,生物医药产业创新将逐渐分化,产业分工向区域纵深发展转变,生物安全构建产业发展新窗口,政策闭环式改革持续推进。面对国内外产业发展新趋势与新形势,中国生物医药产业还需要进一步强化创新研发能力,持续推进医保改革,提升医疗服务水平,推进药械集采结构转型,细化医药产业引导基金制度体系,加速产业数字化转型。
01发展回顾
(一)规模端:显著提升后逐步趋于回落
2021年,医药制造业保持较高速率增长。截至11月,全年每月工业增加值同比增速均超过15%,最高月同比增速达34%,其中有5个月同比增速均超过25%。同时,2021年全年每月同比增速均高于全国工业整体增速。受国内外新冠肺炎疫情的持续影响,治疗需求增加、民众采购意愿增强等叠加因素影响,2021年上半年度我国医药产品保持较大需求,特别是与肺炎疫情防治相关的药品以及防疫物资实现迅猛增长;随着疫情形势有所缓解节以及防控进入常态化,相关医药产品的需求逐渐下降,医药行业市场逐渐进入冷静期,2021年下半年度同比增速趋于回落,截至2021年11月,同比增速回落至17%。
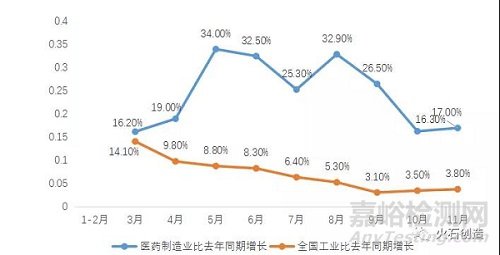
图1:2021年医药制造业增加值与全国工业分月同比增速
(二)领域端:研发创新实力稳步增强,产业结构进一步优化升级
1.中药:国家政策持续利好,产业创新实力逐步增强
国家大力支持中医药产业发展。2021年,国家相继印发《关于加快中医药特色发展的若干政策措施》、《中药配方颗粒质量控制与标准制定技术要求》、《关于进一步加强综合医院中医药工作推动中西医协同发展的意见》等文件,从中药研发创新、行业标准化、医疗服务等方面加强高位谋划与指导,推动中医药产业健康长远发展。
中药行业创新实力逐步增强。新药受理方面,中药新药数量大幅攀升。2021年度CDE受理中药总量为1360件,其中,新药申请60件,申请数量较2020年增加32件,增幅达114.29%。新药上市方面,数量为近五年最高。2021年共有12款新药获批上市,占近五年中药获批新药总数的54%。其中,清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒均来源于古代经典名方,是抗击新冠疫情有效方药清肺排毒汤、化湿败毒方、宣肺败毒方的成果转化。
2.化学药:新药研发硕果累累,以抗感染类药物为主
研发创新持续深化推进。改良型新药方面,2021共有14个品种获批上市,其中抗感染类4个,与神经系统类药物同属第一;齐鲁制药获批的针对精神分裂症和哮喘的2款口溶膜,在该领域竞争优势明显。创新药方面,2021年共有21个国产1类化学新药获批上市,获批数量再次创下药品注册分类新标准实施后的历史新高,抗感染类药物数量最大,占比达38%,其中16个产品以“优先审评”的方式获批,且10个产品已通过谈判进入国家医保目录。此外,和黄医药的赛沃替尼片是国内首个获批的特异性靶向MET激酶的小分子抑制剂,注射用磷酸左奥硝唑酯二钠则是扬子江药业获批上市的首个国产化学1类新药。
3.生物药:研制与生产成果突出,创新活力和增长潜力大
创新成果取得重要突破。2021年,疫苗、抗体药物、重组蛋白、血液制品、细胞和基因治疗等生物药领域创新成果突出,重组蛋白药物、血液制品新增上市产品数量是2020年的6倍。康希诺与军事科学院军事医学研究院联合研发的重组新型冠状病毒疫苗是国内目前获批上市唯一采用单针免疫的新冠疫苗;荣昌生物的维迪西妥单抗是中国首个同时获得美国FDA、中国NMPA突破性疗法双重认定的原创抗体偶联(ADC)药物;丽珠生物的重组人绒促性素是国内首款、全球第二上市产品;复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液是我国目前仅上市的两款用于治疗大B细胞淋巴瘤CAR-T产品,实现了零的突破。
4.医疗器械:带量采购趋势渐明朗,创新产品审评审批程序加快
高值医用耗材带量采购走向常态化。继首批高值耗材冠脉支架国家集中采购结束后,其他高值医用耗材的集采也在2021年同步推进。截至2021年8月底,冠脉球囊和人工晶体均已在31个省份开展集采,实现全覆盖;9月14日,人工关节高值耗材的国家集采在天津开标;冠脉导引导管、导丝集采也于11月在赣冀鲁豫鄂桂渝滇陕九省联盟率先启动。
加快医疗器械创新产品上市。截至2021年12月31日,CMDE已将357个纳入创新医疗器械特别审查程序的产品进行公示,并有累计120个产品通过该程序获批上市。其中,2021年共有60个创新医疗器械产品被纳入特别审批,占纳入特别审查程序产品总数的16.8%;28个产品成功获批上市,占获批上市产品总数的23.3%。
(三)政策端:医药、医疗和医保联动改革持续深化
1.医药方面,完善审评原则体系、建设药品专利体系、鼓励研发创新
一是完善审评原则体系。《生物类似药相似性评价和适应症外推技术指导原则》、《已上市生物制品药学变更研究技术指导原则(试行)》、《生物制品变更受理审查指南(试行)》等一系列总体性原则出台,进一步加强了药物全生命周期管理,优化了审评审批中的流程要求。二是推动药品专利体系建设。《药品专利纠纷早期解决机制实施办法(试行)》、《药品专利纠纷早期解决机制行政裁决办法》等政策出台,标志着中国药品专利链接时代的到来。三是鼓励研发创新。《以临床价值为导向的抗肿瘤药物临床研发指导原则》、《创新药临床药理学研究技术指导原则》等政策出台,强化对创新药的研发指引,细化药物研发监管内容,提升规范程度,并进一步推动我国医药产业从跟随创新到源头创新转变。
2.医疗方面,聚集全民医疗保障,推进公立医院改革,推广分级诊疗经验
一是聚集全民医疗保障。《“十四五”全民医疗保障规划》指出要深化审评审批制度改革,促进群众急需的新药和医疗器械研发使用,并对未来五年全民医疗保障指明了发展方向。二是深化公立医院改革。《深化医疗服务价格改革试点方案》提出到2025年,深化医疗服务价格改革试点经验向全国推广。《公立医院高质量发展促进行动(2021-2025年)》明确了“十四五”时期公立医院高质量发展的具体行动。三是推广分级诊疗经验。《关于推广三明市分级诊疗和医疗联合体建设经验的通知》提出了推进分级诊疗和医疗联合体建设的重点工作任务,并进一步明确了推广三明模式是今后一段时期国家医改工作的重点。
3.医保方面,带量采购常态化发展、医保目录动态更新、医保支付方式纵深改革
一是药械带量采购工作常态化发展。《关于推动药品集中带量采购工作常态化制度化开展的意见》、《关于开展国家组织高值医用耗材集中带量采购和使用的指导意见》等政策陆续发布,国家“带量采购”工作制度化、常态化,逐渐成为十四五期间药品集采的主流,并进一步促进带量采购的范围从药品向医疗器械领域扩大。二是医保目录动态更新。《2021年国家医保药品目录调整工作方案》推出,促进医保目录进一步优化,并加快新药、罕见病用药和抗癌药进入医保进程。《关于建立完善国家医保谈判药品“双通道”管理机制的指导意见》政策出台,各地积极探索"双通道"的管理机制,极大提高了谈判药品的可及性。三是医保支付方式改革向纵深发展。国家医疗保障局印发《DRG/DIP支付方式改革三年行动计划》,指出未来三年,将以加快建立管用高效的医保支付机制为目标,分期分批加快推进,到2025年底,DRG/DIP支付方式覆盖所有符合条件的开展住院服务的医疗机构,基本实现病种、医保基金全覆盖。
(四)空间端:四大集聚区战略布局与政策环境建设持续优化
1.长三角地区:强化全链条政策体系建设
长三角地区全链条政策支撑体系持续完善,浦东新区生物医药产业政策环境优势逐渐凸显。上海、杭州分别出台《上海市人民政府办公厅关于促进本市生物医药产业高质量发展的若干意见》《杭州市人民政府办公厅关于加快生物医药产业高质量发展的若干意见》,皆提出建立健全全产业链政策支撑体系,进一步完善生物医药产业空间布局;国务院发布《中共中央国务院关于支持浦东新区高水平改革开放打造社会主义现代化建设引领区的意见》,明确提出要加快推动浦东高水平改革开放,在长三角一体化发展中更好发挥龙头辐射作用;十三届全国人大常委会第二十九次会议表决通过了关于授权上海市人民代表大会及其常务委员会制定浦东新区法规的决定,为未来区域生物医药产业高质量创新发展奠定了良好的政策环境。
2.环渤海地区:协同创新与特色化发展并行
环渤海地区聚焦协同创新、特色化发展与精准施策。北京市发布实施《北京市加快医药健康协同创新行动计划(2021—2023年),在提升原始创新策源能力、推动临床溢出效应显现、推动第三方专业服务平台与孵化器建设、完善产业发展生态等方面聚焦建设。天津市出台《天津市生物医药产业发展“十四五”专项规划》,注重融合发展与场景应用突破,谋求领标企业聚集培育中心、生物医药应用场景创新示范中心、生物医药产业智能发展中心三大中心建设。河北省石家庄市出台《关于支持新一代电子信息产业和生物医药产业率先突破的若干措施》,并配套发布13项实施细则,从重大专项、研发总部、企业间协作配套、项目引进等层面精准发力。辽宁、山东等省份重点地区系统推进医疗服务、医药服务和药械制造的协同创新发展。
3.粤港澳大湾区:政策引导前沿领域与技术快速发展
粤港澳大湾区对细胞与基因产业发展进行立法,出台全国首个合成生物专项扶持政策。深圳市发布《深圳经济特区细胞和基因产业促进条例(征求意见稿)》,该条例是深圳市人大常委会运用经济特区立法权,在细胞与基因这一新兴领域进行探索。深圳市光明区推出《深圳市光明区关于支持合成生物创新链产业链融合发展的若干措施》,成为全国首个合成生物专项扶持政策,这也将进一步完善区域合成生物“科研-转化-产业”全过程创新生态链,推动中国合成生物产业高速发展。
4.成渝地区双城经济圈:国家战略导向下产业协同发展加速推进
成渝地区双城经济圈建设上升为国家战略,助推区域医药健康产业集群化、协同化发展。目前,四川健康产业与信息产业的融合正在不断加深,三医+的发展趋势愈加明显,并呈现出区域集聚态势。重庆市将生物医药产业作为战略性新兴产业进行重点培育,并持续优化区域产业高质量发展路径。2021年10月,中共中央、国务院印发《成渝地区双城经济圈建设规划纲要》,指出将在成渝地区重点培育具有国际竞争力的先进制造业集群,协同发展生物医药、医疗器械、现代中药产业,共建西部大健康产业基地,创新“一区多园”、“飞地经济”等建园方式,推动各类开发区和产业集聚区政策叠加、服务体系共建。
(五)资本端:上市与投融资活跃度保持上升态势
1.上市企业:新增数量显著增长
2021年,中国生物医药领域新增121家上市企业,较2020年增长超75%。2月、6月和12月成为年度上市高峰期。从交易市场看,在上交所上市50家,香港证券交易所上市30家,深交所上市27家,美国NASDAQ证券交易所上市5家,代办转让市场(新三板)上市5家,北交所上市4家。
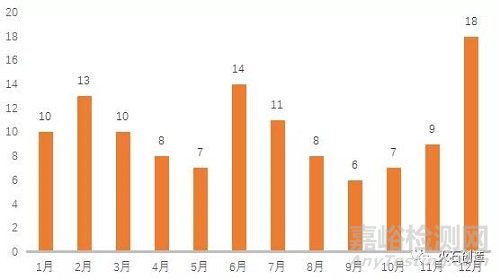
图2:2021年生物医药领域上市公司
新增数量月度分布图(单位:家)
2.融资分析:TOP10省市占全国融资数量和金额的九成
2021年,全国生物医药领域共发生融资事件1894起,已披露的融资金额累计为2618.85亿元。其中,融资活动最为活跃的TOP10省市地区融资事件和融资金额均占全国总量90%以上。从地域分布来看,上海(367起)、江苏(331起)、北京(325起)是融资数量最多的三个省市;上海(710.72亿元)、广东(553.55亿元)、江苏(460.98亿元)是融资金额最高的三个省市。
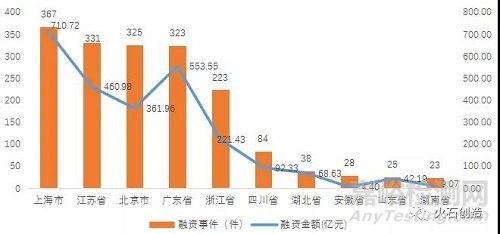
图3:2021年生物医药领域融资数量
和融资金额TOP10省市情况(单位:亿元)
02趋势研判
(一)创新呈现分化态势,构建并增强原始创新供给能力将持续成为主旋律
2021年研发创新奏响“冰与火之歌”,化学药和生物药领域存在热门靶点扎堆布局的局面,随着《新型抗肿瘤药物临床应用指导原则(2021年版)》的发布,研发创新将回归以临床价值为导向的“原始创新”目标。另一方面,“十四五”期间支持建设国家实验室、区域科技创新中心,激励企业加大研发投入等国家层面政策的出台,进一步彰显未来构建原始创新供给能力的决心,其中作为国内产业引领区的上海市,陆续收到科技部、国家药监局的“政策大礼包”,共同支撑打造世界级生物医药产业“自主创新”供给新高地。
(二)产业分工向区域纵深发展转变,数字化产业治理将成为重构产业差异化发展的首选路径
在以国内大循环为主体、国内国际双循环相互促进的国家战略要求下,未来国内生物医药产业链将向区域整合和纵深发展转变。在此之下,数字化产业治理将成为重构产业差异化发展的首选路径,国家“十四五”规划纲要首次将“打造数字经济新优势”提升到国家战略高度,明确提出以数字化转型整体驱动生产方式、生活方式和治理方式变革。2021年开年,浙江省、上海市等东区沿海发达区域已在数字改革层面开展实践。以浙江省为例,提出打造“产业大脑+未来工厂”,其中生物医药产业作为第一批行业产业大脑建设应用试点,实行揭榜挂帅,着力推动产业精准治理与服务。未来利用产业数字化新基建重构产业生态将成为越来越多生物医药产业园区的标配。
(三)生物安全能力和合规体系建设提出新要求,生物安全构建产业发展新窗口
《生物安全法》2021年贯彻实施,伴随着与生物安全相关的系列顶层设计方案的确定执行,国家及地方将加快推动生物安全工程建设,“侦、检、消、防、治”体系化的技术、产品、企业、设施和平台架构将逐步构建完善。生物安全领域的战略科技力量进一步强化提升,在高致病性病原微生物防控、生物安全检测和应急处置、前沿交叉等层面的一批关键核心技术将加快推动攻关突破。高等级生物安全关键防护装备、可穿戴/远程传染病诊疗高端设备、抗病毒疫苗药物等生物安全产品加快研制上市。区域传染病医疗中心、生物安全科创基地等一批以“生物安全”为主题的产业基地规划建设。高等级病原微生物实验室、信息和实体资源库等生物安全“新基建”设施加快布局建设。研究、开发、应用生物技术,保障实验室生物安全和保障中国生物资源和人类遗传资源的安全三大领域将倒逼生物医药企业持续构建生物安全能力和合规体系。
(四)全球化进程加速与国际合作风险并存,推动生物医药供应链自主安全可控、全面融入国际标准将成为国际化发展的重要选择
国内药企正融入更高水平的全球化产业生态圈层,将加快主导推动创新研发、临床运营及项目管理、市场合作、销售队伍建设等多个环节联动的全球化资源配置,持续推进与海外创新型企业、跨国龙头药企的双向合作,加强licence-in和licence-out两种模式的同步开展。热门靶点新药、AI影像等新兴业态、特色原料药等领域将加快国际化商业进程。生物医药国际化进程仍亟待应对部分发达国家“对华”全面竞争限制的升级态势,海外技术引进、科技交流和对外投资仍面临较大挑战,原料药、生物技术开发、疫苗等领域的出口管制仍面临较大的不确定性,增强产业链供应链自主安全可控将成为未来国内生物医药产业发展的着力点。全面融入国际审评审批标准也将成为国内创新型企业出海的首要选择。
(五)破除瓶颈制约,“三医联动”政策闭环改革持续推进
伴随着2021年全民医疗保障第一个五年规划发布及多个重磅政策实施,医疗、医保、医药联动改革步入深水区。DRG/DIP 支付方式改革将成为深化改革重点,进一步推动医院内部运营管理机制转变;带量采购由试点走向常态化、制度化,并从常规化学药逐步进入生物药、高值耗材、中成药领域;超说明书用药、长期处方、国谈药物“双通道”、处方药网售等政策将持续加快探索落地,带来新的市场机会点;临床专科能力、互联网医疗、公立医院综合改革等工作将加快推进。原料药、医美美妆、医疗器械、前沿生物技术等各类产业的监管法规将持续完善。
03政策建议
(一)强化创新驱动,激活生物医药高质量发展新动力
加快推进关键共性技术攻关,助力提升生物医药创新竞争力。针对基础研究环节薄弱等痛点问题,依托国内知名高校、科研机构集聚全球顶尖科学团队在合成生物学、脑科学、生物医学大数据等领域加快建设重大科技基础设施,引领原始技术创新突破。继续大力支持高端医疗影像、新型体外诊断产品、新靶点化学药、抗体药物、基因药物、细胞产品、多肽药物及酶工程等关键零部件研制,强化对产业瓶颈和关键核心技术的攻关。
大力提升公共创新服务平台功能,优化生物医药创新服务生态。优化提升具有共性需求的公共技术服务平台,如新药靶点发现和药物筛选平台、药物评价平台、实验动物中心、医疗器械检验检测等,为创新企业提供全流程关键技术服务。积极搭建政府、企业、医疗机构、高校、科研院所等沟通合作平台,推进“政产学研医”协同创新。
积极发挥龙头企业创新主体作用,补齐生物医药创新服务短板。加快培育引进行业龙头合同研发机构(CRO)、合同外包生产机构(CMO)、合同定制研发生产机构(CDMO)等生物医药产业应用基础平台。鼓励龙头企业向平台化和一体化发展,支持其构建各类服务型平台,实现产业链数据、信息和资源的汇聚,形成发展内循环,并通过产业链以商招商服务于本地产业生态,提升地方服务率。
(二)持续推进医保改革,提升医疗服务水平
加大医保资金对互联网医疗的支持力度。针对民众对互联网诊疗需求的提升,进一步降低互联网医疗机构准入门槛,扩大其医保支付范围,加快探索将符合条件的“互联网”医疗服务纳入保障范围。鼓励各地政府探索“互联网”医疗服务,优先在省级层面打通互联网诊疗服务医保线上报销渠道。基于国家放开网售处方药前提,进一步完善网售处方药监管体系,并探索将网售处方药纳入医保支付范围。推进更多罕见病药物加快纳入医保、集采。结合临床治疗用药需求、医保筹资能力等因素,加快将疗效确切、医保基金能够承担的罕见病药物纳入医保支付范围,进一步提升罕见病患者保障水平。积极探索“孤儿药”、短缺药的采购机制,指导地方针对非过评药品及生物制剂等纳入集采。依托各省采购平台加强供需对接,推动“孤儿药”保供稳价。进一步降低药品流通成本。在三明市、泰州市等城市探索“一票制”基础上,加大政策研究,在全国推广“一票制”,鼓励药品生产企业与公立医疗机构之间直接结算药品货款,促进药品经营行业集中度进一步提升。支持全国各省份优先实施医疗耗材“一票制”,并逐步向药品推广。鼓励医药经销商转变业务模式,由医药耗材代理销售转型配送服务。
(三)推进药械集采结构转型,实施“提质增效”工程
站位结构转型升级前沿,实施“提质增效”工程,形成具备国际竞争力的高质量产业体系。结合2021年集采政策、疫情发展等因素,建议围绕五点实施“提质增效”工程,一是创新药“突破计划”,以重大疾病为核心,加大对医药技术研发突破,培育大品种和新品种。二是“首仿药“支持计划”,以临床应用为导向,引导高端仿制药研发生产,支持生物类似药、具有较高临床价值的药械组合产品。三是高端器械“自主计划”,以国产替代为目标,鼓励掌握核心技术的创新产品产业化,推动一批重点医疗器械升级换代和质量性能提升。四是中药创新“传承计划”,以质量标准为根本,形成更加规范化、标准化的产品体系,延伸中医药内涵,扩大品牌中药的产品衍生。五是BT-IT发展“融合计划”,以创新应用为特征,发挥新一代信息产业优势与渗透力,培育医疗健康大数据、智慧医疗等健康新业态。
未来在集中带量采购常态化的背景下,可以进一步细化集采评估考量细则,研究微创新采购政策,鼓励相关企业加强质量把控,加大产品创新力度,促使行业健康有序发展。
(四)细化医药产业引导基金制度体系,降低融资门槛
2021年,国家在政策、融资等多方面对生物医药产业基金发展给予支持,取得了一定成效,现做如下建议:
借鉴以色列、澳大利亚等地区的生物医药产业引导基金模式,制定制度体系,拓展海外市场。第一,明确股权转让的方式和事先的退出承诺,政府提前做出退出安排,在子基金出资阶段,承诺在投资的五年之内,另外两方可优先回购政府股份;第二,合理的制度体系,发布一套非常严谨的《基金计划指南》,包括计划的目标、申请成为该计划基金管理人的标准以及该计划的管理信息,对参股基金申请、评审形成一套非常严谨的体系;第三,大力拓展海外市场和海外上市途径,积极争取吸引国际资本,把合作伙伴的范围拓展到国际领域,借助海外资本的活动平台,为本地企业提供海外上市的途径。
充分发挥政策引导作用,重点提高国有创投基金的灵活度。提高生物医药引导基金出资比例、规模及让利,引导民间资本积极参与融资活动。鼓励国有资本参与长周期投资,扩大融资总规模。对技术的资本化和股权化给予税收优惠。在创新平台的认定、税收减免、成本加计抵扣方面实施备案制。提高国有创投基金使用灵活度。推进优质的生物医药及医疗产品尽快纳入医保,通过扩大产品市场规模拓宽融资渠道。
设计多样化产品,探索保险参与科技成果转化过程。设立国家级生物医药产业引导基金、投资基金,深度聚焦、精准扶持重大项目。对企业生命周期各阶段,特别是对生物医药瞪羚企业的初创期,有针对性地提供融资服务,重点探索保险参与科技成果转化过程,创新保险产品,银行和基金等投资机构应“因地、因时制宜”地设计产品。
引入新型“政银”风险分担模式,降低中医药领域中小微企业融资门槛和风险。借鉴安徽、湖北等地推出的“4231”新型银政担合作模式,鼓励地方政府探索在中医药领域建立“政银”风险分担模式。如由省级再担保机构与地市中医药领域监管部门(如地市食品药品监督管理局)、银行业金融机构、合作融资担保机构签订合作协议,明确风险分担比例及各自职责。通过建立健全完善的中医药融资担保风险分担机制,降低中医药领域中小微企业融资门槛和风险,激活中小企业创新活力,提升中医药产品整体规模和质量。
(五)破解数字经济落地路径,推进生物医药数字创新服务平台建设
建议产业主管部门创新机制,深入推进“双创”,推进地区生物医药数字创新服务平台建设。数字化大幅提升了企业内部资源配置效率,降低了企业内部交易成本,随着市场交易成本的降低,企业逐步走上了专注于核心竞争能力的专业化、轻量化发展道路。但生物医药产业具有研发链条长、投入大、所需研发服务专业性强、仪器设备昂贵等特点。因此需要在产业链各个环节深入推进“双创”,促进生物医药研发产业发展,使研发服务等各项资源能够有效提供、精准匹配、高效协同。路径方面,建议各地区建设生物医药线上线下一体协同的创新服务平台,线上工作主要是知识图谱构建、大数据中台、企业数字画像构建、企业应用服务场景搭建,线下工作主要是创新服务实体空间建设,整合全球及全国的优质资源供应链服务商、专业技术服务商,运用“平台+运营”的模式,汇聚优质上游供应链资源、实现区域服务资源集聚,无缝、精准地向下游中小企业提供从研发到上市全生命周期各类安全可控、质优价稳的产品和技术服务。平台将有效管理创新资源,帮助国内创新型企业便捷获取发展资源,突破技术瓶颈,为创新发展提供新引擎。

来源:火石创造


